
由相同条件下的三个反应:
2A-+B2=2B-+A2
2C-+A2=2A-+C2
2B-+D2=2D-+B2
可以判断正确的是……( )。
A、氧化性:A2>B2>C2>D2 B、还原性:A->B->C->D-
C、2A-+D2=2D-+A2反应可以进行 D、2C-+B2=2B-+C2反应不能进行
科目:高中化学 来源: 题型:阅读理解

| ||
| (一定条件) |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol-L-1?min-1) |
7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
《物质结构与性质》模块选择题
1.下列性质不能用金属键理论解释的是
A.导电性 B.导热性 C.延展性 D.锈蚀性
2.下列说法错误的是
A.O3与SO2的结构与性质相似
B.硫粉不溶于水,易溶于CS2中
C.Be(OH)2是两性氢氧化物
D.在相同条件下, 的沸点高于
的沸点高于![]()
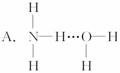
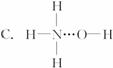
3.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,根据氨水的性质可推知NH3·H2O的结构式为


《有机化学基础》模块选择题
4.已知某有机物A的分子式C2H6O的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
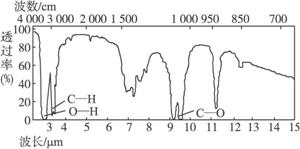
未知物A的红外光谱
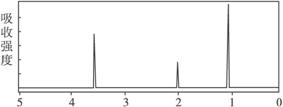
未知物A的核磁共振氢谱
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C.仅由其核磁共振氢谱可知其分子中的各类型氢原子总数
D.则A的结构简式为CH3—O—CH3
5.在阿司匹林的结构简式(下式)中①②③④⑤⑥分别标出了其分子中的不同的键。将阿司匹林与足量NaOH溶液共煮时,发生反应时断键的位置是
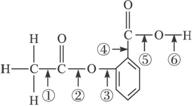
A.①④ B.②⑤ C.③④ D.②⑥
6.举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如下式,下列有关该物质的说法正确的是
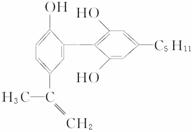
A.该分子中所有碳原子可以稳定地共存在一个平面中
B.1 mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol
C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D.滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省衡水中学高二下学期期末考试化学试卷(带解析) 题型:填空题
(11分)T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省凉山州高三第三次诊断理综化学试卷(解析版) 题型:填空题
已知:

有机化合物A-I有如下转化关系:

其中通过三种现代仪器分析法得知有机物A的相关信息如下

(l)写出下列有机化学反应类型:反应①____ ;反应③ 。
(2)由H通过缩聚反应生成的链状高分子化合物的结构简式为 ;
I是高分子化合物,其链节为 。
(3)写出反应②的化学方程式 。
(4)写出满足下列条件的有机物结构简式____。
①该有机物与A具有相同的相对分子质量
②该有机物的核磁共振氢谱有三个峰且峰面积之比为1:1:6
③该有机物能发生银镜反应
④1mol该有机物与Na反应生成0 5mol氢气
(5)当1molF分别在一定条件下与足量的Na2CO3、NaHCO3和金属Na反应时,产生的气体的物质的量分别是 mol、____mol、____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com