
 2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是
2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1。N:2 mol C 、y mol D;达平衡时c(A)="0.6" mol·L-1。下列推断的结论中不正确的是 

科目:高中化学 来源:不详 题型:填空题
 2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

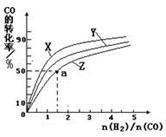
A.CO与HbO2反应的平衡常数K= |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )
cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )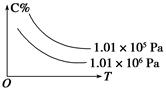
| A.ΔH<0 ΔS>0 | B.ΔH>0 ΔS<0 |
| C.ΔH>0 ΔS>0 | D.ΔH<0 ΔS<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器
N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器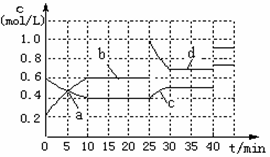
| A.a、b、c、d四个点中处于平衡状态的点是a、b |
| B.反应进行至25min时,曲线发生变化的原因是加入了 0.4molN |
| C.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度 |
| D.若40min后出现如图所示变化,则可能是加入了某种催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1| A.体系压强保持不变 |
| B.混合气体的密度保持不变 |
| C.CO与H2的浓度之比为1∶2 |
| D.单位时间内,消耗2molH2的同时消耗1mol CH3OH |
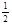 O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+ 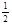 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+ CO(g)
H2(g)+ CO(g) 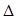 H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。| A.缩小容器体积,平衡向左移动 | B.加入催化剂,CO的产率增大 |
| C.增加碳的量,H2O(g)的转化率增大 | D.降低温度,H2O(g)的转化率降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)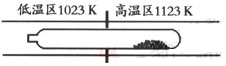
| A.在不同温度区域,TaI4 的量保持不变 |
| B.在提纯过程中,I2 的量不断减少 |
| C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
| D.该反应的平衡常数与TaI4 和S2 的浓度乘积成反比 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com