
| A | B | AxBy | |
| 甲 | 8g | 4g | 11g |
| 乙 | 7g | 5g | 11g |
| A. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO | B. | Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$ FeS | ||
| C. | 3Fe+2O2$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4 | D. | 2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 |
分析 由表格数据可知,得到的化合物AxBy的质量均为11g,则甲中B完全反应,即A、B的恰好反应时质量比为7:4,以此来解答.
解答 解:由表格数据可知,得到的化合物AxBy的质量均为11g,则甲中B完全反应,即A、B的恰好反应时质量比为7:4,
A.由反应可知,Cu与氧气的质量比为2×64:32=4:1,故A不选;
B.由反应可知,Fe与S的质量比为56:32=7:4,故B选;
C.由反应可知,Fe与氧气的质量比为3×56:2×32=21:8,故C不选;
D.由反应可知,Fe与氯气的质量比为2×56:3×71=112:213,故D不选;
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握表格数据分析及A、B反应的质量比为解答的关键,侧重分析与计算能力的考查,注意判断过量计算,题目难度不大.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O含有的分子数为1NA个 | |
| B. | 1mol/L 的MgCl2溶液中,含有Cl-个数为2NA个 | |
| C. | 温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA个 | |
| D. | 常温常压下,1mol氦气含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a | |
| B. | 已知某温度Ksp(Ag2S)=6×10-30,Ksp(AgCl)=2×106,则2AgCl(g)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数y约为6.7×10-37 | |
| C. | 在25℃,将2amol•L-1的氨水与0.02mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3•H2O的电离常数K1=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+CO32- | |
| C. | NH4HCO3溶于过量的浓KOH溶液:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2S${O}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | CH3COOH?H++CH3COO- | ||
| C. | NH3+H2O═NH${\;}_{4}^{+}$+OH- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2.8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | NaOH与HCl的反应 | D. | 甲烷与O2的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都是高分子化合物 | |
| B. | 油脂是产生能量最高的营养物质,油脂水解得到高级脂肪酸和甘油 | |
| C. | 糖类、油脂、蛋白质都是只由C、H、O三种元素组成的 | |
| D. | 用米汤检验加碘食盐中的碘酸钾(KIO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
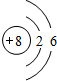 .
. ,该化合物分子内存在共价键,E的钠盐属于离子化合物.
,该化合物分子内存在共价键,E的钠盐属于离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com