
【题目】下列有关化学用语的用法中,正确的是
A. BaCO3的电离方程式:BaCO3![]() Ba2++CO32—
Ba2++CO32—
B. 向沸水中滴加饱和氯化铁溶液得到红褐色液体的化学方程式:3H2O+FeCl3=3HCl+Fe(OH)3↓
C. 向酸性KI溶液中通入臭氧(O3)的离子方程式:2I—+O3+H2O==I2+O2+2OH—
D. 向Ba(OH)2溶液中滴入 NaHSO4溶液至恰好完全沉淀时,反应的离子方程式Ba2++OH—+SO42—+H+==BaSO4↓+H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(I)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应
2HI(g)的平衡常数K1为49,则该温度下反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K2为____________。
HI(g)的平衡常数K2为____________。
(II)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
(5)在800℃时,发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJB.557 kJC.188 kJD.436 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
B.硅单质可用作光导纤维的原料
C.CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物醇A与羧酸B发生酯化反应生成分子式为C9H18O2的酯,0.5molA完全燃烧产生的气体被足量的澄清石灰水吸收生成200g沉淀,则下列说法正确的是( )
A.A的分子式为C4H8OB.B的分子式为C5H10O2
C.酯C9H18O2在稀硫酸溶液中不水解D.有机物A、B都能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于pH=3的HF溶液的叙述正确的是( )
A.该溶液中由H2O电离出的c(H+)=1.0×10-3 mol·L-1
B.与等体积pH=11的NaOH溶液混合,所得溶液呈中性
C.该溶液中离子浓度大小关系:c(H+)>c(F-)>c(OH-)
D.滴加NaOH溶液至c(F-)=c(Na+)时,溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
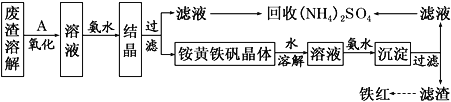
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。
(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。
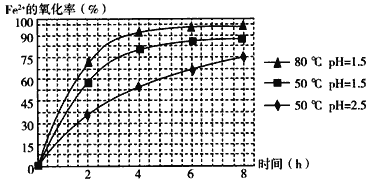
(4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。
(5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。
(6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定:
① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。
④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960gmol-1,计算过程中不考虑固体损失和气体溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究![]() 、
、![]() 与盐酸(浓度为
与盐酸(浓度为![]() )反应过程中的热效应,实验测得的数据如表所示:
)反应过程中的热效应,实验测得的数据如表所示:
序号 | 35mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
① | 水 | 2.5g | 20.0 | 18.5 |
② | 水 | 3.2g | 20.0 | 24.3 |
③ | 盐酸 | 2.5g | 20.0 | 16.2 |
④ | 盐酸 | 3.2g | 20.0 | 25.1 |
由此得出的结论正确的是( )
A.![]() 固体与盐酸的反应是吸热反应
固体与盐酸的反应是吸热反应
B.![]() 固体与盐酸的反应是放热反应
固体与盐酸的反应是放热反应
C.20.0℃时,含3.2g![]() 的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
D.20.0℃时,含2.5g![]() 的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以黄铜矿为原料,采用火法治铜。其中间过程的一个反应的化学方程式为2Cu2O+Cu2S![]() 6Cu+SO2↑,对于该反应下列说法正确的是
6Cu+SO2↑,对于该反应下列说法正确的是
A.氧化产物是Cu
B.还原剂是![]()
C.生成1molCu转移的电子数为2mol
D.![]() 既是氧化剂也是还原剂
既是氧化剂也是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com