
| A.2∶3 | B.3∶2 |
| C.4∶3 | D.1∶3 |
科目:高中化学 来源:不详 题型:单选题
| A.+1 | B.+2 | C.+3 | D.+4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 mol
mol| A.①④ | B.②③ | C.①③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1/5 mol | B.2/5 mol |
| C.3/5mol | D.11/5 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2O | B.NO | C.NO2 | D.N2O3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.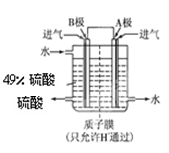
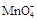 + —— Fe3++ Mn2++
+ —— Fe3++ Mn2++ 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 | B.2 | C.3 | D.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com