
| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
分析 A.缩小容器体积,平衡逆移,NO2浓度增大;
B.保持容器体积不变,加入少许NO2,压强增大;
C.加入少许N2O4,平衡正移,NO2浓度增大;
D.浓度越大速率越大.
解答 解:A.缩小容器体积,平衡逆移,NO2体积分数减小,但是NO2浓度增大,所以混合气体颜色变深,故A错误;
B.保持容器体积不变,加入少许NO2,压强增大,重新达到平衡时,与原平衡相比较,平衡逆向移动,则NO2的体积分数减小,故B错误;
C.保持容器体积不变,加入少许N2O4,平衡正移,NO2浓度增大,所以气体颜色变深,故C正确;
D.保持容器体积不变,加入少许NO2,反应物的浓度增大,则反应速率增大,故D错误.
故选C.
点评 本题考查化学平衡、反应速率的影响因素,把握温度、浓度、压强对反应速率及平衡的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
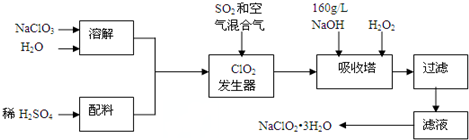
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O4(g)═2NO2(g),改变某一条件后,气体颜色加深 | |
| B. | H2(g)+I2(g)═2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2 | |
| C. | N2(g)+3H2(g)═2NH3(g),改变某一条件后,NH3的体积分数增加 | |
| D. | 2SO2(g)+O2(g)═2SO3(g),恒温恒压条件下,充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
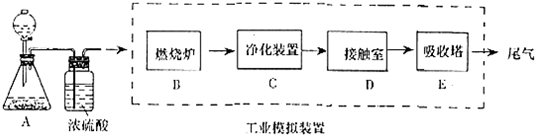

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
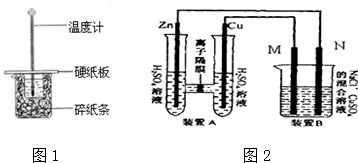
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com