
【题目】100mL浓度为2mol.L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量6 mol.L-1的盐酸
B.加入少量醋酸钠固体
C.加热
D.加入少量金属钠
科目:高中化学 来源: 题型:
【题目】(一)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是 (填序号),写出反应⑥的化学方程式__ 。
(二)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)丙烯是石化工业的主要原料之一,由于市场对丙烯的需求量激增,丙烷脱氢制丙烯的技术日益受到重视。某研究机构需得到C3H8(g)===3C(石墨,s)+4H2(g)的ΔH,但直接测定实验难进行,可通过下图中各组物质能量总和及相互间转化中的能量变化计算得到:

①判断:ΔH________0(选填“>”、“<”或“=”)。
②ΔH=___________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的反应的热化学方程式: _ _ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s[K] | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中处处有化学,化学是人类进步的关键。下列表述错误的是
A. 汽车排放的尾气和冬季取暖排放的颗粒污染物是形成雾霾的一个因素
B. 泡沫灭火器中用的是小苏打和硫酸铝
C. 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同
D. 从海水中可提取镁,电解熔融氯化镁可制得金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.0g AO32- 中核外电子数比质子数多6.02×1022个,下列说法中正确的是
A.A元素的相对原子质量为12
B.AO32-的摩尔质量为60
C.3.0gAO32- 的物质的量是0.02mol
D.A原子的摩尔质量32g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸和盐酸组成的混合液100.0 mL,向其中加入氢氧化钡粉末4.275g,充分反应后,经过滤、洗涤、干燥,得到沉淀2.330g,同时测得滤液中的OH-离子浓度为0.100 mol·L-1 。(设溶液总体积始终不变)请列式计算
(1)原溶液中硫酸的物质的量为____________。
(2)原混合液中盐酸的物质的量浓度_______________。
(3)若将原硫酸和盐酸混合溶液100ml与足量金属锌反应,则在标况下产生的气体体积为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-据此判断以下叙述中错误的是( )
NH4++NH2-据此判断以下叙述中错误的是( )
A. NH3、NH4+、NH2-的电子数相等,化学性质也相同
B. 一定温度下,液氨中c(NH4+)·c(NH2-)是一个常数
C. 液氨的电离达到平衡时c(NH3)≠c(NH4+)=c(NH2-)
D. 加入其他物质,液氨中c(NH4+)与c(NH2-)的比值可能不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
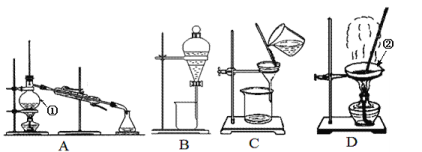
(1)装置A中仪器①的名称是_____________,装置D中仪器②的名称是_____________。
(2)从氯化钾溶液中得到氯化钾固体,应选择装置___________(填代表装置图的字母,下同);从碘水中分离出I2,选择装置__________,该装置的主要仪器名称是_________。分离饱和食盐水与沙子的混合物,应选择装置__________,分离四氯化碳(沸点为76.75℃)和甲苯(110.6℃)的混合物,应选择装置__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com