
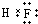 ;A的最高价氧化物对应水化物的化学式为HNO3.
;A的最高价氧化物对应水化物的化学式为HNO3.
分析 A、B、C为短周期元素,根据这几种元素在周期表中的位置知,A和C位于第二周期、B位于第三周期,B2-的结构示意图为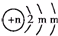 ,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8-2=16,所以B是S元素,A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,再结合物质的性质分析解答.
,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8-2=16,所以B是S元素,A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,再结合物质的性质分析解答.
解答 解:A、B、C为短周期元素,根据这几种元素在周期表中的位置知,A和C位于第二周期、B位于第三周期,B2-的结构示意图为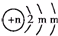 ,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8-2=16,所以B是S元素,A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,
,第二电子层上最多排列8个电子,所以m=8,B核内质子数=2+8+8-2=16,所以B是S元素,A、C两种元素的原子核外电子数之和等于B原子的质子数,结合三种元素的位置知,A是N元素、C是F元素,
(1)通过以上分析知,A为N,B为S,C为F,故答案为:N;S;F;
(2)B为S元素,S原子核外有3个电子层、最外层电子数是6,所以B位于周期表中第三周期VIA族,故答案为:三;VIA;
(3)C为F,C的氢化物的电子式为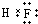 ,A的最高价氧化物对应水化物是硝酸,其化学式为HNO3,故答案为:
,A的最高价氧化物对应水化物是硝酸,其化学式为HNO3,故答案为: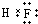 ;HNO3;
;HNO3;
(4)B为S,C为F,已知SF6在温度高于45度时为气态,SF6属于共价化合物,故答案为:共价.
点评 本题考查了元素周期表和元素周期律的综合应用,根据原子结构及元素在周期表中的位置确定元素,再结合元素周期律来分析解答,题目难中等.


科目:高中化学 来源: 题型:选择题
| A. | 储氢、释氢过程均无能量变化 | |
| B. | NaHCO3只含离子键 | |
| C. | 储氢过程中,NaHCO3被还原 | |
| D. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 原子结合成分子过程中一般释放出能量 | |
| C. | 周期表中所有元素都是从自然界中发现的 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用 | |
| B. | 联合制碱法最终副产物为氯化铵,原子利用率小于100% | |
| C. | 步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁 | |
| D. | 海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②⑥ | B. | 只有③⑥ | C. | 只有③④ | D. | 只有⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH2PO4水溶液呈酸性,其溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-) | |
| B. | O.1 mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合(PH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+) | |
| C. | O.1 mol•L-1的(NH4)2SO4溶液与O.1 mol•L-1的NH3•H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-) | |
| D. | O.1 mol•L-1的Na2CO3溶液与O.2 mol•L-1的NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率通常用单位时间内反应物或生成物的物质的量浓度变化来表示 | |
| B. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| C. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| D. | 若某化学反应的反应速率为0.5mol/(L•s),就是指在1s内反应物和生成物的浓度变化都为0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
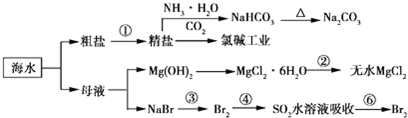
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝是活泼金属,但在空气中耐腐蚀 | |
| C. | MgO可以与Al组成铝热剂,进行铝热反应 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com