
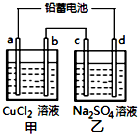
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4(s)+2H2O(l) | |
| C. | 若利用甲池精炼铜,b极应为粗铜 | |
| D. | 若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下) |
分析 原电池放电时,正极发生还原反应,电极反应是PbO2+4H++SO42--2e-=2H2O+PbSO4,负极为Pb+SO42--2e-=PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+;
电解一段时间后,c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,则c是阴极、d是阳极,a是阴极、b是阳极,据此分析解答.
解答 解:原电池放电时,正极发生还原反应,电极反应是PbO2+4H++SO42--2e-=2H2O+PbSO4,负极为Pb+SO42--2e-=PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+;
电解一段时间后,c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,则c是阴极、d是阳极,a是阴极、b是阳极,
A.通过以上分析知,c是阴极、d是阳极,故A错误;
B.放电时,正极反应式为PbO2+4H++SO42--2e-=2H2O+PbSO4,负极为Pb+SO42--2e-=PbSO4,故B错误;
C.电解精炼粗铜时,粗铜为阳极,所以为b电极,故C正确;
D.电解析出6.4gCu,其物质的量是6.4g÷64g/mol=0.1mol,转移0.2mol电子,c电极上生成0.1mol氢气、d电极上生成0.05mol氧气,b电极上析出0.1mol氯气,所以生成气体体积=(0.1+0.05+0.1)mol×22.4L/mol=5.6L,故D错误;
故选C.
点评 本题考查原电池和电解池原理,明确离子放电顺序是解本题关键,难点是电极反应式的书写,注意D中采用转移电子守恒进行计算,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
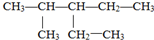 的名称是2-甲基-3-乙基戊烷;
的名称是2-甲基-3-乙基戊烷;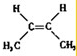 ;
;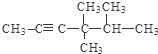 .
.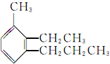 的系统名称为3-甲基-2-乙基丙苯.
的系统名称为3-甲基-2-乙基丙苯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③ | C. | ①②④ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
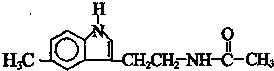 脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )| A. | 该物质有苯环属于芳香烃,1mol该物质能与5molH2加成 | |
| B. | 其分子式为C13H15N2O | |
| C. | 该物质不能与溴水反应 | |
| D. | 该物质能发生水解反应并生成乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x<n时,钠生成的氢气最多 | B. | x=n时,钠、镁、铝生成的氢气一样多 | ||
| C. | n<x≤2n时,生成的氢气钠<镁=铝 | D. | x≥2n时,生成的氢气钠<镁<铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;仅由极性键形成的非极性分子的结构式为
;仅由极性键形成的非极性分子的结构式为 ,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.
,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com