
| A. | CaH2+2H2O═Ca(OH)2+2H2↑ | B. | 2F2+2H2O═4HF+O2 | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | 2Na2O2+H2O═4NaOH+O2↑ |
分析 根据有元素化合价变化的反应为氧化还原反应,水中H、O元素的化合价均不变,则水在氧化还原反应中既不作氧化剂又不作还原剂.
解答 解:A.H2O中H元素的化合价降低,则属于氧化还原反应,水作氧化剂,故A不选;
B.反应中水中O元素的化合价升高,则属于氧化还原反应,水作还原剂,故B不选;
C.反应没有元素的化合价变化,不属于氧化还原反应,故C不选;
D.Na2O2中O元素的化合价既升高又降低,则属于氧化还原反应,但水中H、O元素的化合价均不变,则水在氧化还原反应中既不作氧化剂又不作还原剂,故D选;
故选D.
点评 本题考查氧化还原反应,明确元素的化合价是解答本题的关键,并熟悉氧化还原反应中的概念来解答,难度不大.


科目:高中化学 来源: 题型:解答题
| 溶质的物质的量浓度/mol•L-1 | 溶液的密度/g•cm-3 | 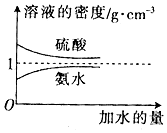 | |
| 硫酸 | c1 | ρ1 | |
| 氨水 | c2 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3与CH3CH(CH3)2 | B. | CH3CH═C(CH3)2与CH2═CHCH(CH3)2 | ||
| C. | 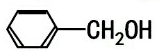 与 与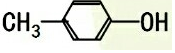 | D. | 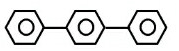 与 与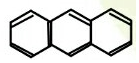 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开啤酒盖,立即有气体逸出 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | NO2和N2O4的混合体系,压缩容器体积,颜色变深 | |
| D. | 工业生产硫酸的过程中使用过量的O2,以提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
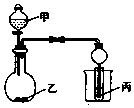 用如图装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项正确的是 ( )
用如图装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项正确的是 ( ) | 甲 | 乙 | 丙 | 试管中的现象 | |
| A | 浓硫酸 | 亚硫酸钠 | 石蕊试液 | 先变红后褪色 |
| B | 浓硝酸 | 铜 | KI-淀粉溶液 | 溶液变蓝色 |
| C | 醋酸 | 粉末状贝壳 | BaCl2溶液 | 变浑浊 |
| D | 浓氨水 | 生石灰 | FeCl2溶液 | 最后生成白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
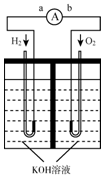 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 电极a和电极c都发生氧化反应 | |
| B. | 电极d的电极反应式为2H++2e-=H2↑ | |
| C. | 装置X中通入SO2的速率为2.24L•min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为1.16L•min-1 | |
| D. | 装置X中每消耗64g SO2,理论上装置X和装置Y中均有1mol H+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液得到FeCl3固体--加热蒸干 | |
| B. | 除去Cu粉中混有的CuO--加入稀硝酸溶解、过滤、洗涤、干燥 | |
| C. | 分离NaNO3和BaSO4的混合物--溶解、过滤 | |
| D. | 除去NaOH溶液中混有的少量Na2SO4--加入BaCl2溶液、过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com