
分析 (1)二氧化氮和水反应生成硝酸和一氧化氮;
(2)Cu+具有还原性,NO2-具有氧化性,二者可发生氧化还原反应生成NO;
(3)①设NO的物质的量为x mol,则NO2的物质的量为$\frac{1.12L}{22.4L/mol}$-x mol=(0.5-x )mol,再根据得失电子守恒,铜失去电子数等于氮得到电子数,求出x,进而求出V(NO2);
②根据氮原子守恒,n(HNO3)=n(被还原HNO3)+n(Cu(NO3)2)×2,求出原硝酸溶液的浓度.
解答 解:(1)二氧化氮和水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(2)Cu+具有还原性,NO2-具有氧化性,二者可发生氧化还原反应生成NO,反应的离子方程式为Cu++NO2-+2H+=Cu2++NO↑+H2O,
故答案为:Cu++NO2-+2H+=Cu2++NO↑+H2O;
(3)设NO的物质的量为x mol,则NO2的物质的量为$\frac{1.12L}{22.4L/mol}$-x mol=(0.5-x )mol,
因为 Cu-2e-═Cu2+,HNO3+e-═NO2,HNO3+3e-═NO
根据得失电子守恒有$\frac{38.4g}{64g/mol}$×2=xmol×3+(0.5-x )mol×1,
解得 x=0.35mol
NO2的体积为(0.5-0.35)mol×22.4L•mol-1=3.36L,
因为HNO3~NO、HNO3~NO2,所以,由氮元素守恒可知:n(被还原HNO3)=n(NO)+n(NO2)=0.5mol;
38.4g铜与150mL一定浓度的硝酸恰好完全反应,溶液中的溶质全部为Cu(NO3)2,
由氮原子守恒:n(HNO3)=n(被还原HNO3)+n(Cu(NO3)2)×2=0.5mol+$\frac{38.4g}{64g/mol}$×2=1.7mol,
则原硝酸溶液的浓度为:c(HNO3)=$\frac{1.7mol}{0.150L}$=11.3mol•L-1,
故答案为:3.36;11.3.
点评 本题考查硝酸的性质及根据性质进行计算、氮的氧化物的性质及其对环境的影响,硝酸具有强氧化性和酸性,可以和不活泼金属如铜发生反应,既表现酸性又表现强氧化性,计算时注意守恒法的应用.


科目:高中化学 来源: 题型:选择题
| A. | CH2O、C2H4O2、C6H12O6 | B. | H2、CO、CH3OH | ||
| C. | CH2═CH2、C2H5OH、HOCH2CH2COOH | D. | C6H6、C5H12、C7H6O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
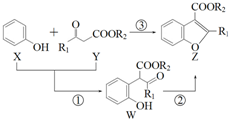 如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述一定正确的是( )
如图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基).则下列有关叙述一定正确的是( )| A. | 反应①属于加成反应 | B. | 1molZ完全加成需要3molH2 | ||
| C. | X与W属于同系物 | D. | X、Y、Z、W都能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和H2S | B. | SO2和SiO2 | C. | NH4Cl和HCl | D. | CCl4和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用米汤检验食盐中是否含碘酸钾(KIO3) | |
| B. | 用食醋除去暖水瓶中的薄层水垢 | |
| C. | 医用酒精的浓度通常为75%,可用于杀菌消毒 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
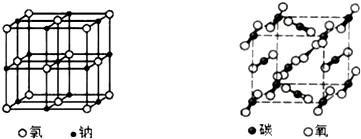
| A. | 两种晶体内均含有共价键 | B. | 构成两种晶体的微粒均是原子 | ||
| C. | 两者的硬度、熔沸点差别较大 | D. | 两种晶体均属于离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
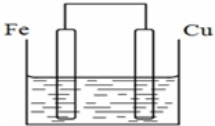 若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如图,一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为0.02mol.
若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如图,一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为0.02mol.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
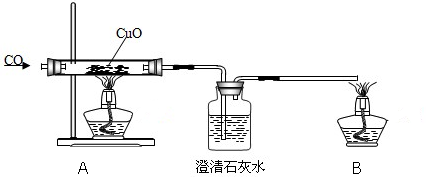
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com