
| A.Fe | B.Na | C.Ag | D.Si |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 负极 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
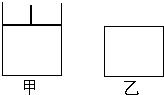 如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变.向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃.保持温度不变发生反应:
如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变.向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃.保持温度不变发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
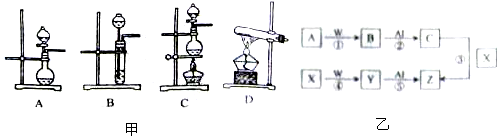
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期阶段检测试化学试卷 题型:选择题
下列金属中,有一种物质与其它物质的冶炼方法不同,它是 ( )
A.Na B.Mg C.Al D.Fe
【题文】下列除杂所选用的试剂及操作方法不正确的一组是 ( )
|
选项 |
待提纯的物质 |
选用的试剂 |
操作方法 |
|
A |
NaBr溶液(NaI) |
溴水 |
萃取分液 |
|
B |
SiO2固体(CaCO3) |
盐酸 |
过滤 |
|
C |
FeCl2溶液(FeCl3) |
铁粉 |
过滤 |
|
D |
CO2气体(HCl) |
Na2CO3溶液 |
洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列金属中,有一种物质与其它物质的冶炼方法不同,它是 ( )
A.Na B.Mg C.Al D.Fe
【题文】下列除杂所选用的试剂及操作方法不正确的一组是 ( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaBr溶液(NaI) | 溴水 | 萃取分液 |
| B | SiO2固体(CaCO3) | 盐酸 | 过滤 |
| C | FeCl2溶液(FeCl3) | 铁粉 | 过滤 |
| D | CO2气体(HCl) | Na2CO3溶液 | 洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com