

| A. | 左侧电极发生氧化反应 | |
| B. | 右侧生成的气体能使湿润的淀粉碘化钾试纸变蓝 | |
| C. | 电解一段时间后,B口排出NaOH溶液 | |
| D. | 电解饱和食盐水的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ |
分析 电解饱和食盐水时,电解池阳极A,发生:2Cl─-2e-=Cl2↑,阴极B,发生2H++2e-=H2↑,电解的总反应:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;生成的氯气会和氢氧化钠之间反应得到氯化钠和次氯酸钠,但是加上阳离子交换膜可以避开这一反应,据此回答.
解答 解:A、电解池阳极A,发生:2Cl--2e-=Cl2↑,为氧化反应,故A正确;
B、阴极B,发生2H++2e-=H2↑,不是氯气,故B错误;
C、阴极B,发生2H++2e-=H2↑,生成NaOH,故C正确;
D、电解饱和食盐水时,电解池阳极A,发生:2Cl─-2e-=Cl2↑,阴极B,发生2H++2e-=H2↑,电解的总反应:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,故D正确;
故选B.
点评 本题以电解氯化钠为例来考查学生电解池的工作原理知识,注意知识的归纳和整理是关键,难度中等.


科目:高中化学 来源: 题型:解答题

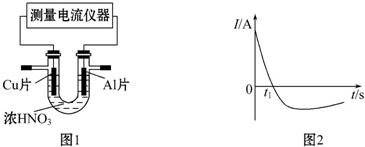
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧时化学能全部转化为热能 | |
| B. | 需要加热才能发生的化学反应,一定是吸热反应 | |
| C. | 化石燃料在燃烧过程中会产生污染环境的有害气体 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5×10-13mol•L-1 | B. | 0.02 mol•L-1 | C. | 1×10-2 mol•L-1 | D. | 1×10-12 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 浓度 时间 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 |
| 0 | 0.8 | 1.6 | 0 |
| 2min | 0.6 | x | 0.2 |
| 4min | 0.3 | 0.8 | 0.5 |
| 6min | 0.3 | 0.8 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体都带电荷,因而都有电泳现象 | |
| B. | 鉴别胶体和溶液可用渗析法 | |
| C. | 血清透析和制豆腐利用胶体的性质相同 | |
| D. | 胶体的胶粒直径在1nm~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | Na2S | C. | KI | D. | CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com