
【题目】已知A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
D元素简单离子半径是该周期中最小的 |
E元素是该周期电负性最大的元素 |
F所在族的元素种类是周期表中最多的 |
G在周期表的第十一列 |
(1)已知BA5为离子化合物,写出其电子式__。
(2)B基态原子中能量最高的电子,其电子云在空间有__个方向,原子轨道呈__形。
(3)实验室制备E的单质的离子反应方程式为__。
(4)BE3在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式__;该反应说明其中B和E中非金属性较强的是__填元素的符号。
(5)C与D的第一电离能大小为__。D与E的最高价氧化物对应水化物相互反应的离子方程式为__。
(6)G价电子排布图为__,位于__纵行。F元素的电子排布式为__,前四周期中未成对电子数最多的元素在周期表中位置为__(填周期和族)。
【答案】![]() 3 纺锤或哑铃 MnO2+4H++2Cl-
3 纺锤或哑铃 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O NCl3+3H2O=3HClO+NH3↑ N Mg>Al Al(OH)3+3H+=Al3++3H2O
Mn2++Cl2↑+2H2O NCl3+3H2O=3HClO+NH3↑ N Mg>Al Al(OH)3+3H+=Al3++3H2O 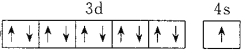 11 [Ar]3d14s2或1s22s22p63s23p63d14s2 第四周期第VIB族
11 [Ar]3d14s2或1s22s22p63s23p63d14s2 第四周期第VIB族
【解析】
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,则A为H;B元素原子的核外p电子数比s电子数少1,则排布式为1s22s22p3,为N;根据C原子的电离能,判断最外层有2个电子,则为Mg;D元素简单离子半径是该周期中最小的,则为Al;E元素是该周期电负性最大的元素Cl;G在周期表的第四周期第十一列,为Cu;元素种类最多的族为IB族, F为第四周期IB族,为Sc。
(1)A、B分别为H、N,则BA5为离子化合物,为氢化铵,电子式为![]() ;
;
(2)B为N,能量最高的电子为3p能级的电子,电子云在空间有3个方向,原子轨道呈纺锤形;
(3)E为Cl,实验室制备氯气时,用二氧化锰与浓盐酸共热制取,离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)B、E分别为N、Cl,NCl3在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的HClO和氨气,方程式为NCl3+3H2O=3HClO+NH3↑;反应中N的化合价由+3变为-3,有较强的非金属性;
(5)C、D分别为Mg、Al,镁最外层电子为3s2,为全充满的稳定结构,则第一电离能大于Al;高氯酸为强酸,氢氧化铝与高氯酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O;
(6)G为Cu,价电子排布图为![]() ;位于11纵行;F为Sc,电子排布式为[Ar]3d14s2或1s22s22p63s23p63d14s2;前四周期中未成对电子数最多的元素的价电子排布式为3d54s1为Cr,位置为第四周期VIB族。
;位于11纵行;F为Sc,电子排布式为[Ar]3d14s2或1s22s22p63s23p63d14s2;前四周期中未成对电子数最多的元素的价电子排布式为3d54s1为Cr,位置为第四周期VIB族。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】碳、硫的含量影响钢铁性能。某兴趣小组用如下流程对钢样进行探究。
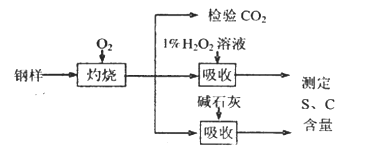
(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,则该固体产物的化学式为_____________。
(2)检验钢样灼烧生成气体中的CO2,需要的试剂是____________ (填字母)。
a.酸性KMnO4溶液 b.澄清石灰水 c.饱和小苏打溶液 d.浓H2SO4
(3)取10.00 g钢样在足量氧气中充分灼烧,将生成的气体用足量1%的H2O2溶液充分吸收,再用0.1000 mol·L-1NaOH溶液滴定吸收液至终点,消耗NaOH溶液20.00mL;另取10.00g钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如下图),碱石灰增重0.614 g。
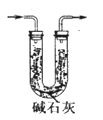
①用l%H2O2溶液吸收SO2,发生反应的离子方程式为___________________。
②分别计算该钢样中硫、碳元素的质量分数(写出计算过程)。
③实验测得的碳元素质量分数比真实值偏高,其可能的原因是______________(填字母)
a.U型管中生成的亚硫酸盐吸收了O2
b.碱石灰吸收了空气中的CO2
c.气体通过碱石灰的流速过快,末被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
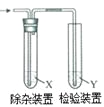
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是 ______ (填序号)。
①采用甲烷为原料,在微波和其他条件下生产金刚石
②采用传统方法用焦炭还原SiO2制备单晶硅
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④在玻璃生产过程中加入K、Pb生产其有特殊用途的光学玻璃
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若该过程中转移的电子为1.60×105mol,不考虑其他的反应,也不考虑生铁中的杂质,则炼得的生铁为 ______t。生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为 ______。
(3)工业炼金属Al的工艺流程如下:
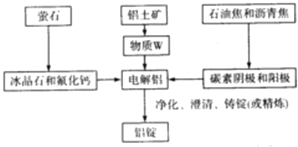
该工艺中冰晶石和氟化钙的作用是 ______,物质W的化学式为 ______ ;若铝土矿的纯度为60%,提取W的损失率为3%,电解时损失率为0.1%,粗铝净化时的损失率为2%,铝锭中铝的含量为99.9%,那么1.0t铝土矿可制备铝锭 ______t。
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 ______,金属防腐措施很多,其中牺牲阳极(金属Zn)的阴极保护法的“阴极”反应式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如下所示。
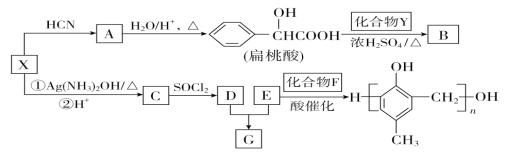
已知以下信息:
①![]()
②![]() (R、R’代表烃基)
(R、R’代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y。
④化合物F的核磁共振氢谱图中只有一个吸收峰。
回答下列问题:
(1)X的含氧官能团的名称是______,X与HCN反应生成A的反应类型是________。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是________________。
(3)X发生银镜反应的化学方程式是______________________________________
(4)G在NaOH溶液中发生水解反应的化学方程式是_________________________
(5)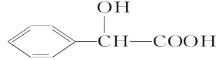 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应的反应物和产物如下,请按要求回答下列问题![]() :
:
(1)如果该化学方程式中S和![]() 的系数分别是5和1,请配平化学方程式
的系数分别是5和1,请配平化学方程式![]() ,并用单线桥标出电子转移的方向和数目:______。
,并用单线桥标出电子转移的方向和数目:______。
(2)该反应中,发生氧化反应的物质是___,该反应中,发生还原反应的过程是____。
(3)反应中,1mol还原剂________![]() 填“得到”或“失去”
填“得到”或“失去”![]() ________mol电子。
________mol电子。
(4)若在标准状况下,反应产生336ml气体,则转移的电子数为________个。
(5)如果没有对该化学方程式中的某些化学计量数做限定,配平的化学计量数有许多组,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图微生物燃料电池结构示意图的说法:①微生物促进了电子的转移 ②微生物所在电极区放电时发生还原反应 ③放电过程中,H+从正极区移向负极区 ④正极反应式为:MnO2+4H++2e-===Mn2++2H2O正确的是( )

A. ④ B. ①③
C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液仅含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的4种离子,所含离子的物质的量均为
中的4种离子,所含离子的物质的量均为![]() 。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法错误的是( )
A.该溶液中所含的离子是:![]() 、
、![]() 、
、![]() 、
、![]()
B.若向该溶液中加入过量的稀硫酸和![]() 溶液,溶液显血红色
溶液,溶液显血红色
C.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
D.若向该溶液中加入足量的![]() 溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为
溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
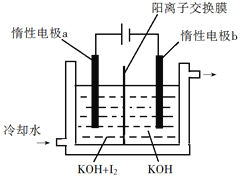
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
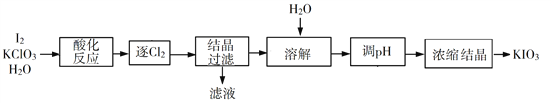
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com