
【题目】下列物质中,含有共价键的是( )
A. KClB. CaOC. CO2D. NaCl
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
【题目】某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2 . 该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2 , 该同学推测反应中可能生成了H2O2 , 并进行实验探究.
(1)写出Na2O2与水反应的化学方程式 .
(2)试设计实验证明溶液X中含过氧化氢 .
(3)通过上述实验证明溶液中确实存在H2O2 . 取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:H2O2+Fe2++OH﹣﹣﹣Fe(OH)3↓,该反应中H2O2表现了性(填“氧化”或“还原”).
(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了性(填“氧化”或“还原”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2 , 其部分生产流程如下: 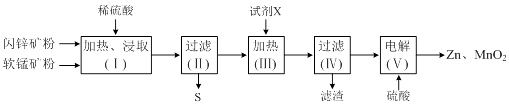
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 .
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: .
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3 . pH调节的范围是 , 试剂X可以选用(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3H2O
(4)电解(Ⅴ)中阳极的电极反应式为 .
(5)Zn和MnO2是制作电池的原料.某锌﹣锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列五组物质:A、O2和O3 B、3517Cl和3717Cl C、CH4与C7H16 D、CH3CH2CH2CH3 与 ![]()
(1)组两种物质互为同位素;
(2)组两种物质互为同素异形体;
(3)组两种物质互为同系物;
(4)组两种物质互为同分异构体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学基本观念的认识不正确的是( )
A. 微粒观:一个一氧化碳分子由一个碳原子和一个氧原子构成
B. 能量观:化学反应在生成新物质的同时,还伴随着能量的变化
C. 分类观,生石灰和消石灰都属于碱
D. 守恒观:电解水反应前后,元素种类和原子数目均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验: 请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整. 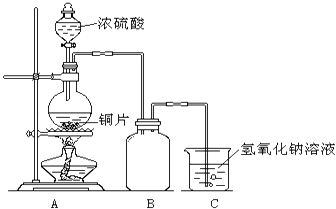
(2)实验中他们取6.4g铜片和12mL18molL﹣1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余. ①写出铜与浓硫酸反应的化学方程式: ,
实验中若有m g铜参加了反应,则有mol硫酸被(填“氧化”或“还原”),转移电子的物质的量为mol.
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是(填写字母编号).
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案: 方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一;
方案二 .
方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全燃烧某烃1.06g,生成标准状况下1.792LCO2和0.9g水.该烃的蒸汽相对氢气的密度为53且该烃能使酸性高锰酸钾溶液褪色,但不能使溴的四氯化碳溶液褪色.写出该烃的分子式以及可能的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3是两种常见的钠盐.
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈色.
(2)等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下产生CO2的体积V(Na2CO3) V(NaHCO3)填“大于”,“小于”或“等于”)
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了 2.48g,则原混合物中碳酸钠的质量分数为 .
(4)①实验室中需2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是 .
A. 1000ml; 212g B.950ml;543.4g C.任意规格; 572g D.500ml; 106g
②需要的玻璃仪器有容量瓶、玻璃棒、烧杯、量筒,还缺少的玻璃仪器有(填写仪器
③名称)若出现如下情况,其中将引起所配溶液浓度偏高的是(填下列编号);
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.定容观察液面时俯视
C.未冷却至室温就开始定容
D.加蒸馏水时不慎超过了刻度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3 区域的是( ) 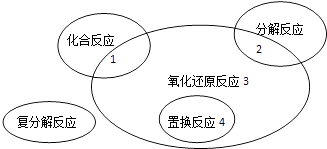
A.Cl2+2KBr═Br2+2KCl
B.2NaHCO3═Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O ![]() 4Fe(OH)3
4Fe(OH)3
D.2Na2O2+2CO2═2Na2CO3+O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com