

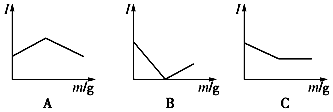
���� ��1������ͼ��֪�������¶ȣ��������ʵ�������˵��ƽ�������ƶ���������Ӧ�Ƿ��ȷ�Ӧ��
��Ϊ���CO2��ƽ��ת���ʣ����ı��¶����������ѹǿƽ��������У�
��2������ͬ�����£�Ͷ�ϱ�[X=$\frac{n��{H}_{2}��}{n��C{O}_{2}��}$]Խ������̼��ת����Խ�ݴ��ж�X1��X2����Դ�С���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���¶�Խ����ƽ�ⳣ��ԽС��
����B���Ͷ�ϱ�Ϊ3���Ҵӷ�Ӧ��ʼ��B����Ҫ10min��n��CO2��=2mol����n��H2��=10mol��B�������̼��ת����Ϊ75%����μӷ�Ӧ��n��CO2��=2mol��75%=1.5mol�����ݶ�����̼������֮��Ĺ�ϵʽ֪���μӷ�Ӧ��n��H2��=3n��CO2��=4.5mol����v��H2��=$\frac{\frac{��n}{V}}{��t}$��
��3���������仯Ϊ̫����ת��Ϊ���ܣ�����ת��Ϊ��ѧ�ܣ�
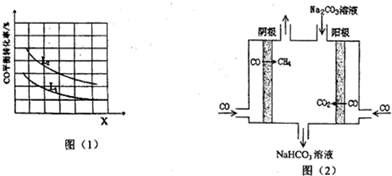
�ڸ���ͼ֪�����������ĵ缫�������������������ĵ�Դ�缫Ϊ�����������϶�����̼�õ��Ӻ������ӷ�Ӧ���ɱ�ϩ��ˮ��
��4���ٸ���ͼ֪��Fe3O4�ڴ���2300Kʱ�ֽ�ΪFeO��O2��
�ڷ�����Ӧ��6FeO��S��+CO2$\frac{\underline{\;2300K\;}}{\;}$2Fe3O4��S��+C������C�����ʵ���������CԪ�ػ��ϼ۱仯����ת�Ƶ��ӣ�
��� �⣺��1������ͼ��֪�������¶ȣ��������ʵ�������˵��ƽ�������ƶ���������Ӧ�Ƿ��ȷ�Ӧ���ʡ�H��0��
�ʴ�Ϊ������
�ڷ�Ӧǰ�����������С��Ϊ���CO2��ƽ��ת���ʣ����ı��¶��⣬���ɲ�ȡ�Ĵ�ʩ������ѹǿ��
�ʴ�Ϊ������ѹǿ��
��2������ͬ�����£�Ͷ�ϱ�[X=$\frac{n��{H}_{2}��}{n��C{O}_{2}��}$]Խ������̼��ת����Խ����ͼ֪����ͬ�¶���X1��ת���ʴ���X2������X1��X2���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���¶�Խ����ƽ�ⳣ��ԽС���¶�A��B������ƽ�ⳣ��A��B��
�ʴ�Ϊ����������
����B���Ͷ�ϱ�Ϊ3���Ҵӷ�Ӧ��ʼ��B����Ҫ10min��n��CO2��=2mol����n��H2��=6mol��B�������̼��ת����Ϊ75%����μӷ�Ӧ��n��CO2��=2mol��75%=1.5mol��
2CO2��g��+6H2��g��?C2H4��g��+4H2O��g��
��ʼ����mol/L�� 1 3 0 0
�仯����mol/L�� 0.75 2.25 0.375 1.5
ƽ������mol/L�� 0.25 0.75 0.375 1.5
K=$\frac{1��{5}^{4}��0.35}{0.2{5}^{2}��0.7{5}^{6}}$=170.7��
���ݶ�����̼������֮��Ĺ�ϵʽ֪���μӷ�Ӧ��n��H2��=3n��CO2��=4.5mol����v��H2��=$\frac{\frac{��n}{V}}{��t}$=$\frac{\frac{4.5mol}{2L}}{10min}$=0.225mol/��L��min����
�ʴ�Ϊ��170.7�� 0.225mol/��L•min����
��3������ǿ���Եĵ����ˮ��Һ�У����Բ������缫������̫���ܽ�CO2ת���ɵ�̼ϩ��������ԭ��ͼ��֪�������仯Ϊ��̫����ת��Ϊ���ܣ�����ת��Ϊ��ѧ�ܣ�
�ʴ�Ϊ��̫����ת��Ϊ���ܣ�����ת��Ϊ��ѧ�ܣ�
�ڸ���ͼ֪�����������ĵ缫�������������������ĵ�Դ�缫Ϊ����������bΪ�����������϶�����̼�õ��Ӻ������ӷ�Ӧ���ɱ�ϩ��ˮ���缫��ӦʽΪ3CO2+18H++18e-=CH3CH=CH2+6H2O��
�ʴ�Ϊ��������3CO2+18H++18e-=CH3CH=CH2+6H2O��
��4���ٸ���ͼ֪��Fe3O4�ڴ���2300Kʱ�ֽ�ΪFeO��O2����Ӧ����ʽΪ2Fe3O4 $\frac{\underline{\;2300K\;}}{\;}$6FeO+O2����
�ʴ�Ϊ��2Fe3O4 $\frac{\underline{\;2300K\;}}{\;}$6FeO+O2����
�ڷ�����Ӧ��6FeO��S��+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4��S��+C������1mol Fe3O4ʱ���Եõ�C�����ʵ���Ϊ0.5mol��ת�Ƶ���Ϊ0.5mol��4=2mol��
�ʴ�Ϊ��2mol��
���� ���⿼�黯ѧƽ����㡢��ѧƽ��ͼ��ԭ��غ͵���ԭ����������ԭ��Ӧ�йؼ��㡢���ؿ���ѧ�����������������ѵ��ǵ缫��Ӧʽ����д��ע���ϵ������Һ�������д����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ | B�� | ��������Ƽ� | C�� | ���顢ҡͷ�� | D�� | ����ù�ء���Ŷ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 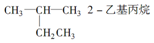 | B�� | CH3CH2CH2CH2OH 1-���� | ||
| C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | n����CO��/mol | n����Cl2��/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ͼ��ʾ�٢ڢֱܷۢ��Ǽ��ֳ���©�����ϲ���A��B��C��D��ʵ�ʲ���Ӧ��ʱ����©�����²����������е�ʾ��ͼ����ָ��A��B��C��D�ֱ���٢ڢۢ���ƥ��Ŀ�����ϣ�A��ۣ� B��ڢܣ���٢ڢܣ���C��٣� D��ܣ�
��ͼ��ʾ�٢ڢֱܷۢ��Ǽ��ֳ���©�����ϲ���A��B��C��D��ʵ�ʲ���Ӧ��ʱ����©�����²����������е�ʾ��ͼ����ָ��A��B��C��D�ֱ���٢ڢۢ���ƥ��Ŀ�����ϣ�A��ۣ� B��ڢܣ���٢ڢܣ���C��٣� D��ܣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 42g NaHCO3�����к���CO32-����ĿΪ0.5NA | |
| B�� | 1 mol OH-��17 g NH3�����ĵ�������� | |
| C�� | 1 mol Cl2�μӷ�Ӧת�Ƶ�����һ��Ϊ2NA | |
| D�� | 2.0g H216O��D216O�Ļ����������������ΪNA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com