
| ʱ��t/s | 0 | 50 | 150 | 250 | 350 |
| n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
���� ��1���ɱ������ݿ�֪��50s�ڡ�n��PCl3��=0.16mol���ɷ���ʽ��֪��n��PCl5��=��n��PCl3��������v=$\frac{\frac{��n}{V}}{��t}$����v��PCl5����
��2��Ҫ���ƽ��ʱPCl3������������ı�����ƽ�������ƶ��������ܼ�СPCl3��Ũ�ȣ�ע��ı�PCl5��Ũ�ȵ�ЧΪѹǿ�ı䣻
��3���¶�ΪTʱ����2.0L�����ܱ������г���1.0mol PCl5��ƽ��ʱn��PCl3��=0.2mol����
PCl5��g��?PCl3��g��+Cl2��g��
��ʼ��mol/L����0.5 0 0
�仯��mol/L����0.1 0.1 0.1
ƽ�⣨mol/L����0.4 0.1 0.1
�ٸ���K=$\frac{c��PCl{\;}_{3}����c��Cl{\;}_{2}��}{c��PC{l}_{5}��}$����ƽ�ⳣ����
��4��ƽ��ʱPCl5��ת������Ϊ20%��ת����PCl5Ϊ0.5mol��20%=0.1mol����ʾ��ƽ��ʱ��������ʵ������ٸ���ƽ�ⳣ���з��̼�����
��5������ˮ�У����Ȼ�����ȫˮ�⣬�������ᣨH3PO4����������HCl��
��� �⣺��1���ɱ������ݿ�֪��50s�ڡ�n��PCl3��=0.16mol���ɷ���ʽ��֪��n��PCl5��=��n��PCl3��=0.16mol����v��PCl5��=$\frac{\frac{0.16mol}{2L}}{50s}$=0.0016mol/��L•s����
�ʴ�Ϊ��0.0016mol/��L•s����
��2��A���¶Ȳ��䣬ѹ�������������ѹǿ��ƽ�������ƶ���PCl3�����������С����A����
B��ʹ�ø�Ч��������Ӱ��ƽ���ƶ���PCl3������������䣬��B����
C���¶Ⱥ�������䣬��СPCl5����ʼ������ЧΪ����ѹǿ��ƽ�������ƶ���PCl3�������������C����
D��������䣬��߷�Ӧ�¶ȣ�����ӦΪ���ȷ�Ӧ��ƽ�������ƶ���PCl3�������������D��ȷ��
�ʴ�Ϊ��CD��
��3���¶�ΪTʱ����2.0L�����ܱ������г���1.0mol PCl5��ƽ��ʱn��PCl3��=0.2mol����
PCl5��g��?PCl3��g��+Cl2��g��
��ʼ��mol/L����0.5 0 0
�仯��mol/L����0.1 0.1 0.1
ƽ�⣨mol/L����0.4 0.1 0.1
��ƽ�ⳣ��K=$\frac{c��PCl{\;}_{3}����c��Cl{\;}_{2}��}{c��PC{l}_{5}��}$=$\frac{0.1��0.1}{0.4}$=0.025��
�ʴ�Ϊ��0.025��
��4�����¶�ΪTʱ������ʼʱ�������г���0.5mol PCl5��a mol Cl2��ƽ��ʱPCl5��ת������Ϊ20%����ת����PCl5Ϊ0.5mol��20%=0.1mol����Ӧ������У���
PCl5��g��?PCl3��g��+Cl2��g��
��ʼ��mol/L����0.25 0 0.5a
�仯��mol/L����0.05 0.05 0.05
ƽ�⣨mol/L����0.2 0.05 0.5a+0.05
��ƽ�ⳣ��K=$\frac{��0.5a+0.05����0.05}{0.2}$=0.025�����a=0.1
�ʴ�Ϊ��0.1��
��5������ˮ�У����Ȼ�����ȫˮ�⣬�������ᣨH3PO4����������HCl����Ӧ����ʽΪ��PCl5+4H2O=H3PO4+5HCl��
�ʴ�Ϊ��PCl5+4H2O=H3PO4+5HCl��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���Ӧ���ʡ�ƽ�ⳣ������ȣ��Ѷ��еȣ���4����ע������ƽ������ʽ���м�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ǿ����ʣ����ᡢ�������������� | B�� | ������ʣ����ᡢ�������� | ||
| C�� | �ǵ���ʣ�Һ������������ | D�� | ͬϵ�CH2O2��C2H4O2��C3H6O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ������ϡ���ᷴӦ��2Fe+6H+�T2Fe3++3H2�� | |
| B�� | ����ˮ��Ӧ��Na+H2O�TNa++OH-+H2�� | |
| C�� | ������̼ͨ�����ʯ��ˮ��CO2+Ca2++2OH-�TCaCO3��+H2O | |
| D�� | ����������Һ��������OH-+H+�TH2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����¶ȣ�H2SŨ�ȼ�С�������÷�Ӧ�����ȷ�Ӧ | |
| B�� | ͨ��CO������Ӧ���������� | |
| C�� | ��ӦǰH2S���ʵ���Ϊ10 mol | |
| D�� | H2S��ƽ��ת����Ϊ28.6% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Һ������ˮ��ֲ���� | |
| B�� | ���Ҵ�����ˮ����ȡ�嵥�� | |
| C�� | ��������ˮ�����Ȼ�̼ | |
| D�� | �ù��˷���ȥ�Ȼ�����Һ�е�̼���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢܢ� | B�� | �٢ڢۢ� | C�� | �ڢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
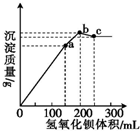 ��100mL0.1mol•L-1��立�[NH4Al��SO4��2•12H2O]��ˮ��Һ�У���ε���0.1mol•L-1��Ba��OH��2��Һ�����ó�����������Ba��OH��2��Һ�����������ͼ��ʾ[��֪Ba��AlO2��2��������]������˵����ȷ���ǣ�������
��100mL0.1mol•L-1��立�[NH4Al��SO4��2•12H2O]��ˮ��Һ�У���ε���0.1mol•L-1��Ba��OH��2��Һ�����ó�����������Ba��OH��2��Һ�����������ͼ��ʾ[��֪Ba��AlO2��2��������]������˵����ȷ���ǣ�������| A�� | a����Һ�д������ڵ�������NH4+��SO42- | |
| B�� | b����Һ��c��NH3•H2O��ԼΪ0.1mol•L-1 | |
| C�� | a��b�����У���Ӧ��ֻ��SO42- | |
| D�� | b��c�����У���Ӧ����Al��OH��3��NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ������������ѧ���ʻ��ã�����Ϊͬ�������� | |
| B�� | �������Ͻ�ı�Ĥ���ϻ�ѧ���ʻ��� | |
| C�� | ԭ�����������ķ��նԶ�������Ĥ��Ʒû��Ӱ�� | |
| D�� | ��������Ĥ��Ʒ���ʺ��������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com