
| A. | 液态HCl不导电,所以HCl不是电解质 | |
| B. | NH3溶于水形成的溶液能导电,所以NH3是电解质 | |
| C. | Cl2溶于水能导电,所以Cl2是电解质 | |
| D. | BaSO4在水溶液中难导电,但熔融下能导电所以BaSO4是电解质 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,原因是二者可以发生双水解反应 | |
| B. | 电解精炼铜时,若阴极得到1.204×1024个电子,则阳极质量减少6.4g | |
| C. | 使甲基橙变红色溶液:Mg2+、K+、SO42-、NO3-能大量共存 | |
| D. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+O2+4H+=2S+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
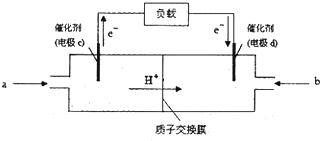
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | CO2的水溶液:c(H+)>c(HCO3-)═2c(CO32-) | |
| C. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 1 L 0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
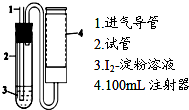 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如下:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制蒸馏水 | |
| B. | 粗盐提纯 | |
| C. | 用氢气还原氧化铜 | |
| D. | 用氯化钠晶体配制100mL0.1mol•L-1的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
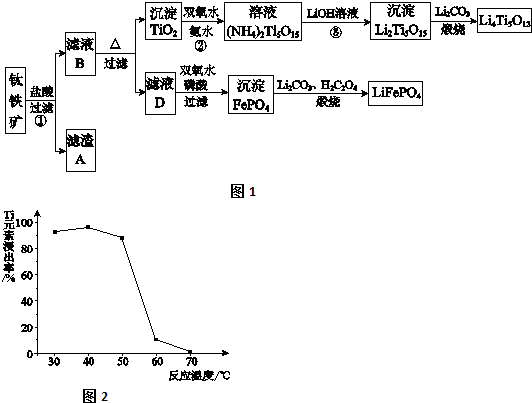
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com