
【题目】现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);△H<0在850℃时,K=1.
CO2(g)+H2(g);△H<0在850℃时,K=1.
(1)若温度降低到950℃时,达到平衡时K______1(填“大于”“小于”或“等于”).
(2)850℃时,若向一容积可变的密闭容器中同时充入1molCO,3molH2O,1molCO2和xmolH2,则:
①当x=5.0时,上述平衡向______(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
【答案】 小于 逆反应 x<3.0
【解析】试题分析:(1)CO(g)+H2O(g)CO2(g)+H2(g);△H<0,在850℃时,平衡常数K=1,升温到950℃时,平衡常数随温度变化,反应是放热反应,升温平衡逆向进行,平衡常数减小,K<1;
(2)①850℃时,若向一容积可变的密闭容器中同时充入 1.0molCO、3.0molH2O、1.0molCO2和 xmolH2,当x=5.0时,反应前后气体体积不变,可以利用物质的量代替平衡浓度计算浓度商,Q=![]() =5/3>K=1,平衡逆向进行;②若要使上述反应开始时向正反应方向进行,满足Q<K,Q=
=5/3>K=1,平衡逆向进行;②若要使上述反应开始时向正反应方向进行,满足Q<K,Q=![]() <1,x<3.0,则x应满足的条件是0<x<3;
<1,x<3.0,则x应满足的条件是0<x<3;


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中 与盐酸反应最剧烈, 与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强。反应的离子方程式为 。
Ⅱ.利用下图装置来验证同主族元素非金属性的变化规律:
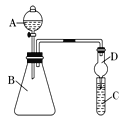
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明。干燥管D的作用是 。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用 溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中 的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由 。因此应在B、D之间增加一个盛有足量 (选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
![]()
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 用蒸馏的方法来分离甲苯、溴苯和辛烷的混合物
B. 催化裂化不仅可以提高汽油的产量,而且可以提高汽油的质量
C. 裂化汽油可使溴水褪色
D. 裂解的目的是获得乙烯、丙烯、丁二烯等短链不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A. 镁条在空气中燃烧 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 铝片与稀盐酸的反应 D. 灼热的炭与CO2的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的锌放人100mLl8.4mol/L浓硫酸中加热,充分反应后锌完全溶解,同时生成气体X 22.4L(标准状况)。将反应后的溶液稀释至0.8L,测得溶液c(H+)=0.1mol/L,则下列判断错误的是
A. 气体X为SO2和H2的混合物 B. 气体X中SO2与H2的体积相等 C. 反应中共转移2mol电子 D. 反应中共消耗Zn 65 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学知识与生产生活息息相关。
I.硅及其化合物
(1)硅及其化合物在现代信息技术中应用广泛。其中用于制造计算机芯片的材料是__________(写化学式),用于制造光导纤维的材料是__________(写化学式)。光导纤维在碱性土壤中易被腐蚀,请写出相关的离子反应方程式______________________
II.氯及其化合物
(2)漂白粉是生活常备用品,其主要成份是__________________(写化学式);漂白粉保存不当易变质,请写出漂白粉失效的方程式________________;如不小心把漂白粉与洁厕灵(主要成份为盐酸)混合,易生成氯气使人中毒。请写出有关反应的离子方程式________________________。
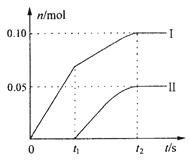
(3)某实验小组,向一定量的石灰乳中缓慢匀速地通入足量氯气,发现产物中还混有了ClO3-,他们讨论后认为,是反应放热温度升高的原因。并画出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为__________mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=______________。
III.氮及其化合物
(4)硝酸生产过程中排放出来的废气,含NO、NO2等大气污染物。
①工业上常用原理:NOx+NH3→N2+H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是_____________;
②已知碱能除去硝酸尾气:2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液吸收的是_______________
A.1molO2和4molNO2
B.1molO2和4molNO
C.1molNO和5molNO2
D.4molNO和1molNO2
(5)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是_____________
A.燃烧含氮化合物燃料
B.燃烧含铅汽油
C.由于燃烧不充分
D.内燃机中空气中的N2在高温下被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图Ⅰ所示的装置制取干燥的氨气。
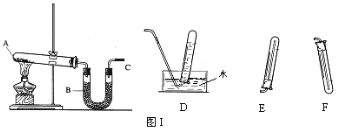
(1)写出A处NH4Cl和Ca(OH)2反应的化学方程式:____________________;
(2)为收集到干燥的氨气C应接(填仪器编号)____________;
(3)B中盛装的试剂是 ;
(4)检验氨气是否集满的方法是__________________________;
(5)在D、E、F三种气体收集方法中,能用于收集一氧化碳的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com