
| A. | 1:l | B. | 8:9 | C. | 3:4 | D. | 6:7 |
分析 涉及反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,溶液中Cu2+与NO3-的物质的量之比为3:7,此时的硝酸根离子是剩余的硝酸根离子,结合方程式计算即可,以此解答该题.
解答 解:对于反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,反应后溶液中Cu2+与NO3-的物质的量之比为3:7,
设溶液中铜离子物质的量是3mol,则消耗硝酸的物质的量是8mol,生成的硝酸铜中硝酸根离子是6mol,所以剩余的硝酸根离子是1mol,反应之前的硝酸是9mol,则参加反应的HNO3与反应前HNO3的总的物质的量之比是8:9.
故选B.
点评 本题考查了硝酸的性质及有关氧化还原反应的计算,为高频考点,把握发生的化学反应为解答该题的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

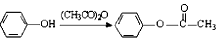
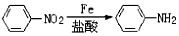
 .
.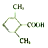 (或
(或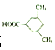 ).
).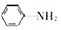 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物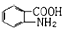 的合成路线
的合成路线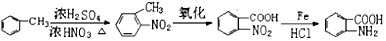 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素的单质可以置换出非金属单质,但不能置换出金属单质 | |
| B. | Na2CO3和SiO2加热生成CO2,说明H2SiO3的酸性比H2CO3的强 | |
| C. | 液氨不能导电,所以液氨是非电解质,氨水能够导电,所以氨水是电解质 | |
| D. | S、Cl2均能和NaOH溶液发生氧化还原反应,且都既作氧化剂又作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Fe | B. | Zn、Ag | C. | Fe、Zn | D. | Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:2 | B. | 1:4:1 | C. | 4:4:1 | D. | 4:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
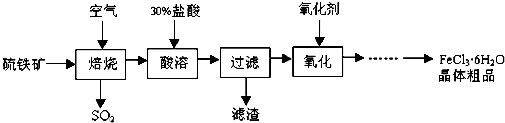
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com