
| A�� | ��ԭ�ӵĽṹʾ��ͼΪ�� ������ԭ�ӵĽṹʾ��ͼΪ�� ������ԭ�ӵĽṹʾ��ͼΪ�� | |
| B�� | ����ԭ������һ��������ɵķ����Ӻ�һ��������ɵķ����� | |
| C�� | ����ԭ�ӵ�Ħ������Ϊ1g/mol | |
| D�� | 21H�ķ���ԭ������2��������ɵķ����� |
���� �������֪����ԭ��ԭ�Ӻ�����һ�����ӣ������磬������һ�����ӣ������磬�ɱ�ʾΪ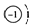 ���Դ˽����⣮
���Դ˽����⣮
��� �⣺A����ԭ�Ӻͷ���ԭ�ӵ����ӡ����ӵ���෴����A��ȷ��
B���������Ϣ��֪������ԭ������һ��������ɵķ����Ӻ�һ��������ɵķ����ӣ���B��ȷ��
C���������䣬����ԭ�ӵ�Ħ������Ϊ1g/mol����C��ȷ��
D��21H�ķ���ԭ������������Ϊ1����1��������ɵķ����ӣ���D����
��ѡD��
���� ������������Ϣ�⣬Ϊ��Ƶ���㣬�����ڿ���ѧ���ķ�����������ѧ�������ѶȲ���ע�����ԭ�ӵĹ��ɣ���ѧ��Ӧ����������Դ��֪ʶ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ʵ�����ʾ���ӡ�ԭ�ӡ����ӡ�����������С�������� | |
| B�� | Ħ���ǹ��ʵ�λ���е��߸�����������֮һ | |
| C�� | 1mol�κ����ʶ����� 6.02��1023��ԭ�� | |
| D�� | 0.012Kg12C����̼ԭ����Ϊ6.02��1023 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ȼ�̼-�ǵ���� �Ȼ���-ǿ����� ̼��-������� | |
| B�� | NO2-���������� CuO-���������� Al2O3-���������� | |
| C�� | �����ᡢ���â������ʯ�ҷֱ������ᡢ��Ρ������� | |
| D�� | ��ơ�������Һ��ˮ�������ײ��Ͼ�Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ�к���2mol K2SO4 | B�� | �ɽ�2mol K2SO4����1Lˮ���Ƶ� | ||
| C�� | ��Һ��c��K+ ��=4 mol•L-1 | D�� | 1L ��Һ�к�4molK+��4molSO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ԭ��Ӧһ�������Ĵ������Ӧ���� | |
| B�� | ������ԭ��Ӧ�У���Ӧ�ﲻ�����������ǻ�ԭ�� | |
| C�� | ��������ԭ��Ӧ�У��������ͻ�ԭ���ȿ����Dz�ͬ����Ҳ������ͬ������ | |
| D�� | ʧ����Խ�࣬��ԭ��Խǿ���õ���Խ�࣬������Խǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H=-285.9kJ/mol | B�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H=-241.8kJ/mol | ||
| C�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H=+285.9kJ/mol | D�� | H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=+241.8kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

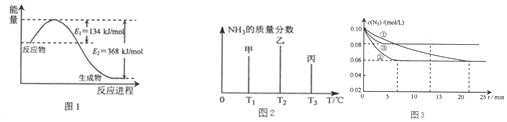
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
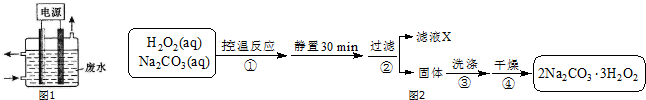
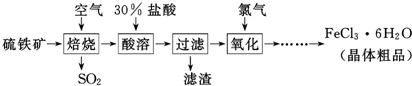
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com