
| A. | 降低温度,H2S浓度减小,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为10 mol | |
| D. | H2S的平衡转化率为28.6% |
分析 A.降低温度,H2S浓度减小,说明平衡正向移动,升高温度,平衡向吸热反应方向移动;
B.通入CO后,正反应速率瞬间增大,又逐渐减小;
C.反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,设反应前H2S物质的量为n,则:
CO(g)+H2S(g)?COS(g)+H2(g) 起始(mol):10 n 0 0
变化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
反应恰好气体分子数目不变,利用物质的量代替浓度代入平衡常数表达式K=$\frac{c(COS)×c(H{\;}_{2})}{c(CO)×c(H{\;}_{2}S)}$列方程计算;
D.根据C中的计算数据计算H2S的平衡转化率.
解答 解:A.降低温度,H2S浓度减小,说明平衡正向移动,升高温度,平衡向吸热反应方向移动,则该反应是放热反应,故A错误;
B.通入CO后,正反应速率瞬间增大,又逐渐减小,故B错误;
C.反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,设反应前H2S物质的量为n,则:
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
变化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
反应恰好气体分子数目不变,可以利用物质的量代替浓度计算平衡常数,则=$\frac{c(COS)×c(H{\;}_{2})}{c(CO)×c(H{\;}_{2}S)}$=$\frac{2×2}{8×(n-2)}$=0.1,解得n=7,故C错误;
D.根据上述数据,可知H2S的平衡转化率为$\frac{2mol}{7mol}$×100%=28.6%,故D正确;
故选D.
点评 本题考查影响化学反应速率的因素、化学平衡常数应用、化学平衡的有关计算,比较基础,注意理解掌握三段式均解题法在化学平衡计算中的应用.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 烧碱、氨、四氯化碳均为电解质 | |
| D. | 胶体、食用盐、点豆腐的卤水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: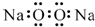 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 硫原子的结构示意图: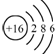 | D. | NH4Cl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和四氯化碳形成的溶液可以用蒸馏的方法来分离 | |
| B. | 用萃取的方法分离汽油和煤油 | |
| C. | 用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | Cr°${\;}_{2}^{-}$ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com