
| A. | 正逆反应速率都增大 | |
| B. | 平衡不移动 | |
| C. | 再次平衡时c(D) 不变 | |
| D. | C的体积分数不再变化说明再次达到平衡 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
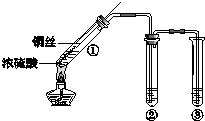 某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).
某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A. | 反应在前50s的平均反应速率为v(PCl3)=0.0064 mol/(L•s) | |
| B. | 若保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol/L,则反应的△H<0 | |
| C. | 相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80% | |
| D. | 相同温度下,起始时向该容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a1、a2均减小 | B. | a1减小,a2增大 | C. | a1、不变,a2增大 | D. | a1不变,a2减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
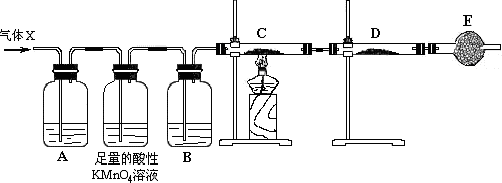
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物的浓度,平衡常数K增大 | B. | 加大体系压强,平衡常数K增大 | ||
| C. | 加入负催化剂,平衡常数K减小 | D. | 升高温度,平衡常数K发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
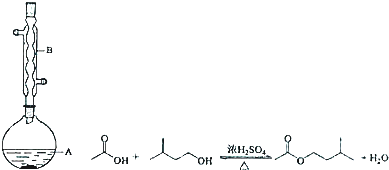
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-Cl | O═O | Cl-Cl | H-O |
| E/(kJ•mol-1) | 431 | 397 | a | 465 |
| A. | 242 | B. | 303.5 | C. | 180.5 | D. | 365 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com