
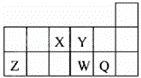
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
|
| A. | 元素X与元素Z的最高正化合价之和的数值等于8 |
|
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ |
|
| C. | 离子Y2﹣和Z3+的核外电子数和电子层数都不相同 |
|
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
考点:
位置结构性质的相互关系应用.
专题:
元素周期律与元素周期表专题.
分析:
根据元素所在周期表中的位置判断元素的种类,结合元素周期律的递变规律解答该题
解答:
解:由元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素.
A、X为N元素,最高正价为+5价,Z为Al元素,最高正价为+3价,则元素X与元素Z的最高正化合价之和的数值等于8,故A正确;
B、原子核外电子层数越多,半径越大,同一周期元素原子半径从左到右逐渐减小,则有:rZ>rW>rQ>rX>rY,故B错误;
C、离子Y2﹣和Z3+的核外电子数都为10,离子核外有2个电子层,电子层数相同,故C错误;
D、同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故D错误.
故选A.
点评:
本题考查位置结构性质的相互关系及应用,题目难度中等,注意掌握元素周期表的结构和元素周期律的递变规律.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
一个体重50 kg的健康人,体内约含有2 g铁,这2 g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1) 在人体中进行Fe2+ Fe3+的转化时,②中的Fe3+作 剂(填“氧化剂”或“还原剂”);
Fe3+的转化时,②中的Fe3+作 剂(填“氧化剂”或“还原剂”);
(2)“服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作 剂;
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的化学方程式为 ;
(4)某食堂为学生准备的一次晚饭食谱为:馒头、牛奶、鸡蛋、米汤、炒辣椒、醋泡咸盐豆。
其中富含维生素C的食物为 ,食醋中常用的防腐剂为 ,
小华同学为了证明该食堂所提供的牛奶中没有添加米汤,他应该做的实验以及观察到的现象为
;
(5)小芳同学在这次晚饭中食用了2 g 加碘(KIO3)食盐,计算她这次晚餐中补充的碘元素质量(mg)。
(设每千克加碘食盐中含KIO3 40 mg,计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机化合物的性质能体现是羟基对苯环产生影响的是( )
A.苯酚溶液显弱酸性 B.苯酚 和乙醇中,分别加入金属钠,苯酚反应剧烈
和乙醇中,分别加入金属钠,苯酚反应剧烈
C.苯酚比苯容易发生溴代反应 D.苯酚能与氢氧化钠溶液反应,而苯甲醇不能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 中和热一定是强酸跟强碱反应放出的热量 |
|
| B. | 1 mol酸与1 mol碱完全反应放出的热量是中和热 |
|
| C. | 在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 |
|
| D. | 测定中和热时可用稀硫酸和稀Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
|
| A. | ﹣488.3 kJ/mol | B. | +488.3 kJ/mol |
|
| C. | ﹣191 kJ/mol | D. | +191 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸.当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素.回答下列问题: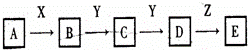
(1)A是 ,Y是 ,Z是 .
(2)当X是强碱时,E是 ,当X是强酸,E是 .
(3)写出A与X反应的离子方程式:
① ;
② .
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示.下列判断正确的是( )

|
| A. | 原子半径:丙<丁<戊 | B. | 氢氧化物碱性:丙>丁>戊 |
|
| C. | 金属性:甲>丙 | D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2006年5月14日某新闻媒体报道齐齐哈尔第二制药有限公司生产的假药事件,“齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C3H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡.二甘醇又称乙二醇醚,分子式为C4H10O3(HO﹣CH2﹣CH2﹣O﹣CH2﹣CH2﹣OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4﹣二恶烷等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛.二甘醇一般的合成路线为:

请回答下列问题:
(1)下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程Ⅰ是石油加工中常用步骤,其名称为 .
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,则为了能得到二甘醇D,物质B到物质C的反应条件是 ,该反应属于 取代反应 (添反应类型).写出B可能生成E的化学方程式: .
(4)物质D是二甘醇,则合成路线中的物质A、B、C的结构简式分别是:
A: B: C:
(5)反应Ⅲ的化学方程式为: .
(6)写出二甘醇制备1,4﹣二恶烷的化学方程式: H.
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含CaO杂质的CaC2试样.设计以下实验,测定CaC2试样的纯度.(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验.
(1)制取C2H2最好选④中的丙,所选用装置的连接顺序是(填各接口A~E的顺序): .
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为 .(保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com