
【题目】某同学利用下列装置探究Na与CO2反应的还原产物,已知PdCl2+CO+H2O==Pd(黑色)↓+CO2+2HCl。下列相关分析错误的是
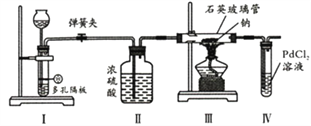
A. I中发生反应可以是Na2CO3+H2SO4==Na2SO4+H2O+CO2↑
B. II中浓硫酸的目的是干燥CO2
C. 实验时,III中石英玻璃管容易受到腐蚀
D. 步骤IV的目的是证明还原产物是否有CO
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对人体健康不会造成危害的事实是
A. 用工业酒精(含甲醇)兑制饮用白酒 B. 用福尔马林浸泡海产品进行防腐保鲜
C. 用二氧化硫漂白食物 D. 在食用盐中加入碘酸钾以消除碘缺乏病
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:

(1)仪器组装完成后,夹好止水夹,_____,则说明装置A的气密性良好.
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)
A.稀硫酸和锌片B.稀硝酸和铁片 C.氢氧化钠溶液和铝片D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号).
①打开止水夹②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________;丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;丁同学预设计实验证明另一种物质是否存在,其方案为__________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列实验:

已知:① 3Fe+4H2O(气)![]() Fe3O4+4H2
Fe3O4+4H2
② Fe3O4可以看成FeO Fe2O3,可溶于盐酸
请回答:
(1)在图I的虚线框中,应选用图Ⅱ中的_________填(“A”或“B”)装置;实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是_________________。
(2)实验后,取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁。该结论是否正确?___________,并说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,具有致癌性。酸性KMnO4溶液与NaNO2反应的化学方程式为:MnO4+NO2+□→ Mn2++NO3+H2O(未配平)。下列叙述中正确的是
A. 该反应中NO2被还原 B. 生成1 mol NaNO3需消耗0.4 mol KMnO4
C. 反应过程中溶液的酸性增强 D. □中的粒子是OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 乙醇和汽油(从石油中提炼)都是可再生能源,应大力推广“乙醇汽油”
B. 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
C. 氢能具有的优点是原料来源广、热值高、储存方便、制备工艺廉价易行
D. 氢能是一次能源(从自然界中以现成形式提供的能源为一次能源)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于sp3杂化轨道说法正确的是( )
A. 凡是中心原子采取sp3杂化方式成键的分子其几何构型都是四面体
B. ![]() 分子中的
分子中的![]() 杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C. 金刚石是三维网状结构,由碳原子从sp3杂化轨道形成共价键
D. NH3和BF3分子中,中心原子均采用sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下反应方程式:
A.CuO+H2![]() Cu+H2O
Cu+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.Cl2+2NaOH==NaCl+NaClO+H2O
D.2FeBr2+3Cl2=2FeCl3+2Br2
E.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
F.KClO3+6HCl(浓)=KC1+3H2O+3Cl2↑
G.HgS+O2=Hg+SO2
I.按要求将上述化学方程式序号填入相应空格内:
(1)一种单质使一种化合物中的一种元素被还原____________________;
(2)同一种物质中,同种元素间发生氧化还原反应________________;
(3)所有元素均参加氧化还原反应的是____________________________。
II.已知方程式F:KClO3+6HCI(浓)=KCl+3H2O+3Cl2↑。
(1)请用双线桥法标出电子转移的方向和数目_______________________;
(2)标准状况下当有33.6L的氯气放出时,转移电子的数目是_________________________;
(3)上述反应中氧化产物和还原产物的质量比为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com