
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
分析 (1)化学平衡常数为平衡时,生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
(2)温度不变,利用浓度商与化学平衡常数的大小,判断平衡移动方向,得到答案;
(3)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(4)分析压强对化学反应速率和化学平衡的影响,得到答案;
(5)电解质能在高温下能传导O2-,负极发生氧化反应,即C8H18)失去电子生成CO2,根据质量守恒和电荷守恒写出电极反应式;
(6)一个电子的电量是1.602×10-19C,当电路中通过1.929×105 C的电量时,电子的个数=$\frac{1.929×10{\;}^{5C}}{1.602×10{\;}^{-19}C}$=1.204×1024,电子的物质的量=$\frac{1.204×10{\;}^{24}}{6.02×10{\;}^{23}mol{\;}^{-1}}$=2mol,根据转移电子和氢氧化钠的关系式计算;
(7)最节能的措施应使用太阳能;原子利用率等于期望产物的总质量与生成物的总质量之比.
解答 解:(1)反应物和生成物浓度不变时,达到平衡状态,3min后达到平衡状态,容器体积为1L,则c(H2O)=0.350mol/L,c(CO)=0.150mol/L,c(H2)=c(CO2)=0.600mol/L-0.350mol/L=0.250mol/L,化学平衡常数表达式为:K=$\frac{[CO{\;}_{2}]•[H{\;}_{2}]}{[CO]•[H{\;}_{2}O]}$=$\frac{0.250×0.250}{0.350×0.150}$=1.2,
故答案为:1.2;
(2)向2L恒容密闭容器中充入1mol CO、1mol H2O(g)、2mol CO2、2mol H2,各物质浓度分别为:0.5mol/L、0.5mol/L、1mol/L、1mol/L,浓度商=$\frac{1×1}{0.5×0.5}$=4>1.2,平衡向逆反应方向移动,所以υ(正)<υ(逆),
故答案为:<;
(3)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1
由盖斯定律可知用①+③-$\frac{2}{3}$②得反应CO(g)+2H2(g)=CH3OH(l),该反应的反应热△H═-283.0kJ•mol-1+(-286kJ•mol-1)-$\frac{2}{3}$(-726.5kJ•mol-1)=-129kJ•mol-1,CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1;
(4)增加压强,缩小体积,反应物浓度增大,反应速率加快,正反应速率加快大于逆反应速率,化学平衡向正反应方向移动,
故答案为:增加压强使反应速率加快,同时平衡右移,CH3OH产率增大;
(5)电解质能在高温下能传导O2-,负极发生氧化反应,即1molC8H18失去电子生成CO2,共失去$8×(4+\frac{18}{8})$mole-=50mole-,18molH原子转化为9molH2O,根据质量守恒和电荷守恒写出电极反应为:C8H18-50e-+25O2-=8CO2+9H2O,
故答案为:C8H18-50e-+25O2-=8CO2+9H2O;
(6)一个电子的电量是1.602×10-19C,当电路中通过1.929×105 C的电量时,电子的个数=$\frac{1.929×10{\;}^{5C}}{1.602×10{\;}^{-19}C}$=1.204×1024,电子的物质的量=$\frac{1.204×10{\;}^{24}}{6.02×10{\;}^{23}mol{\;}^{-1}}$=2mol,根据转移电子和氢氧化钠的关系式得NaOH的质量=$\frac{2mol}{2}$×2×40g•mol-1=80g,
故答案为80;
(7)最节能的措施应使用太阳能,故选a;原子利用率等于期望产物的总质量与生成物的总质量之比,反应b中理论上原子利用率为:$\frac{46}{88+12}$=46%,
故答案为:a;46%.
点评 本题考查影响化学平衡的因素、化学平衡的建立等,难度较大,构建平衡建立的途径进行比较是关键;探讨了能源的循环利用和温室效应的解决,着重考查了物质催化反应的过程,结合考查了化学反应速率和对图表的理解解析能力,综合能力要求较高.另外读图时要注意观察横纵坐标的含义和单位.


科目:高中化学 来源: 题型:选择题
| A. | 在四氯化碳中形成的分散系属于悬浊液 | |
| B. | 分子直径比Na+小,能透过半透膜 | |
| C. | “青蒿素”分子不能透过滤纸 | |
| D. | 在四氯化碳中形成的分散系具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
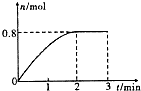 一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2 min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 开始到平衡,用A表示该反应的化学反应速率为0.3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol铁与足量氯气反应,失去的电子数为2NA | |
| B. | 2 L 0.2 mol•L-1 K2SO4溶液SO42- 物质的量浓度为0.4 mol•L-1 | |
| C. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 | |
| D. | 同温同压下,含NA个分子的二氧化碳气体和含NA个分子的氖气体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物的浓度,可增大活化分子的百分数,从而使反应速率增大 | |
| B. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| C. | NH4HCO3 (s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | 升温能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com