
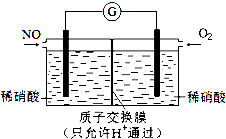
 NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.分析 (1)根据含氮化合物对环境的影响来回答;
(2)①化合价升高值=化合价降低值=转移电子数,根据化合价的变化来确定电子转移数目;
②反应方程式中,系数之比等于物质的量之比;
(3)①根据盖斯定律结合热化学方程式的书写来回答;
②根据化学平衡中的三行式进行计算;
③根据Qc和K的关系来确定化学平衡的移动方向;
(4)在原电池的负极上发生失电子的氧化反应.
解答 解:(1)氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,故答案为:产生光化学烟雾或形成酸雨;
(2)①NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5mol O2(标准状况)时,转移电子的物质的量是1mol,故答案为:1;
②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的系数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,故答案为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(3)①已知:A、NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
B、2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,则反应:2NO(g)+O2(g)=2NO2(g)可以看成是B-2A得到的,所以该反应的△H=-196.6kJ•mol-1-2(-41.8kJ•mol-1)=-113.0 kJ•mol-1,故答案为:2NO(g)+O2(g)=2NO2(g)△H=-113.0 kJ•mol-1;
②设NO2的变化浓度是x,
NO2(g)+SO2(g)?SO3(g)+NO(g)
初始浓度:0.5 0.5 0 0
变化浓度:x x x x
平衡浓度:0.5-x 0.5-x x x
则$\frac{x}{0.5-x}=\frac{3}{1}$,解得x=0.375,所以二氧化氮的转化率=$\frac{0.375}{0.5}$×100%=75%,
故答案为:75%;
③反应的平衡常数K=$\frac{0.375×0.375}{0.125×0.125}$=9,再往容器中同时充入NO2、SO2、SO3、NO各1mol,即浓度各增加0.5mol/L,此时Qc=$\frac{0.875×0.875}{0.625×0.625}$=1.96<K,所以向正反应方向移动,
故答案为:A;
(4)将NO转化为HNO3的原电池中,负极上发生一氧化氮失电子的氧化反应,即NO-3e-+2H2O=NO3-+4H+,
故答案为:NO-3e-+2H2O=NO3-+4H+.
点评 本题考查学生热化学、电化学以及化学平衡的有关计算知识,是考试的重点和难点,难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | Ⅳ | ⅤA | ⅥA | ⅦA | 0 | |
| 二周期 | ① | ② | | |||||
| 三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
 ,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.
,④的元素名称镁,②与⑦形成的化合物属于共价(填“离子”“共价”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目增大 | ||
| C. | 该硫酸铜晶体体积不变 | D. | 溶液的蓝色不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
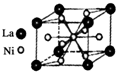 目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.
目前,利用金属或合金储氢已取得很大进展,先后发现了Ni、Mg、Fe基三个系列的储氢材料,如图是一种储氢密度超过液氢的镍基合金的晶胞结构图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | GQXYZ | B. | XYGQZ | C. | GYQZX | D. | GXQYZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为Cl2+2e-=2Cl- | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.01 mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO2)与c(O2)之比k:k甲=k丙>k乙 | |
| B. | SO3的质量m:m甲=m丙>2m乙 | |
| C. | 容器内压强P:P甲=P丙>2P乙 | |
| D. | 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精灯不慎打翻着火用水浇灭 | |
| B. | 直接将浓硫酸倒入盛有水的烧杯中进行稀释 | |
| C. | 固体药品可用镊子或钥匙取用 | |
| D. | 蒸馏操作烧瓶可以直接用酒精灯加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com