
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
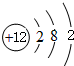 .
.分析 (1)Mg原子核外有12个电子,有3个电子层,各层电子数为2、8、2;
(2)元素非金属性越强,其最高价氧化物对应水化物的酸性越强;
(3)氢氧化铝属于两性氢氧化物,胃酸主要成份为盐酸,氢氧化铝与盐酸反应生成氯化铝与水.
解答 解:(1)Mg原子核外有12个电子,有3个电子层,各层电子数为2、8、2,原子结构示意图为: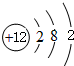 ,故答案为:
,故答案为: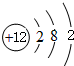 ;
;
(2)同周期自左而右元素非金属性减弱,故非金属性S<Cl,元素非金属性越强,其最高价氧化物对应水化物的酸性越强,故酸性HClO4>H2SO4,
故答案为:HClO4;
(3)氢氧化铝属于两性氢氧化物,胃酸主要成份为盐酸,氢氧化铝与盐酸反应生成氯化铝与水,反应化学方程式为:Al(OH)3+3HCl═AlCl3+3H2O,离子反应方程式为:Al(OH)3+3H+═Al3++3H2O,故答案为:Al(OH)3;Al(OH)3+3H+═Al3++3H2O.
点评 本题考查元素周期律、元素化合物性质等,题目难度不大,注意对元素周期律的理解,掌握基础是解题关键.


科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ | Na+ | Cu2+ | Al3+ |
| 阴离子 | SO42- | HCO3- | NO3- | OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LHA溶液的pH=3.5 | |
| B. | 0.1mol/LHA溶液中,由HA电离出的c(H+)约为水电离出的c(H+)的106倍 | |
| C. | 0.1mol/LNaA溶液中,各离子浓度大小顺序为:c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 向0.1mol/LNaA溶液中加水稀释,所有离子浓度均降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
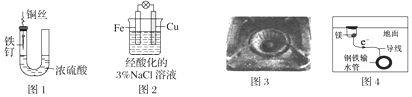
| A. | 图1中,铁钉易被腐蚀 | |
| B. | 图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1醋酸溶液中含有醋酸分子的数目为0.1NA | |
| B. | 25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.2 NA | |
| C. | 常温下,20 L pH=12的Na2CO3溶液中含有OH-数目为0.2 NA | |
| D. | 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子直径大于100nm | |
| B. | 丁达尔效应可以用于检验胶体 | |
| C. | 将FeCl3溶液滴加到氢氧化钠溶液中即可制得氢氧化铁胶体 | |
| D. | 分离胶体和溶液可以采用过滤的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com