
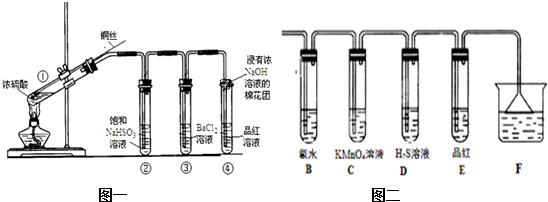
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜和二氧化硫、水;
(2)反应中生成硫酸铜,S元素的化合价降低;
(3)加热挥发出的硫酸能够与氯化钡反应生成硫酸钡沉淀,对二氧化硫的性质检验造成干扰,可以用亚硫酸氢钠除去挥发的硫酸,要立即终止铜与硫酸的反应,可以上移铜丝,使其脱离硫酸,撤去酒精灯,容易发生倒吸,拔去橡胶塞倒出硫酸,操作复杂;
(4)二氧化硫为酸性氧化物,与氢氧化钠反应生成亚硫酸钠溶液,亚硫酸钠与氯化钡反应生成亚硫酸钡沉淀;
二氧化硫具有还原性,能够被氯气氧化生成硫酸根离子,硫酸根离子与氯化钡反应生成硫酸钡沉淀;
(5)棉花团应浸有碱液,可吸收二氧化硫,防止污染空气;
(6)二氧化硫具有还原性,能够被氯气氧化生成硫酸根离子;二氧化硫具有还原性能使高锰酸钾溶液褪色,二氧化硫与硫化氢溶液反应生成硫沉淀.
解答 解:(1)铜与浓硫酸在加热条件下反应生成硫酸铜和二氧化硫、水,化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,反应生成硫酸铜,铜被氧化;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;氧化;Cu元素化合价升高;
(2)反应中生成硫酸铜,表现了硫酸的酸性,S元素的化合价降低,表现了硫酸的氧化性;
故答案为:酸;氧化;
(3)加热挥发出的硫酸能够与氯化钡反应生成硫酸钡沉淀,对二氧化硫的性质检验造成干扰,可以用亚硫酸氢钠除去挥发的硫酸,要立即终止铜与硫酸的反应,可以上移铜丝,使其脱离硫酸,撤去酒精灯,容易发生倒吸,拔去橡胶塞倒出硫酸,操作复杂;
故答案为:a;
(4)二氧化硫为酸性氧化物,与氢氧化钠反应生成亚硫酸钠溶液,亚硫酸钠与氯化钡反应生成亚硫酸钡白色沉淀;
故答案为:生成白色沉淀;
(5)棉花团应浸有碱液,可吸收二氧化硫,防止污染空气,故答案为:吸收二氧化硫;
(6)二氧化硫具有还原性,能够被氯气氧化生成硫酸根离子,反应的化学方程式:SO2+Cl2+2H2O═2HCl+H2SO4;二氧化硫具有还原性能使高锰酸钾溶液褪色,二氧化硫与硫化氢溶液反应生成硫沉淀,硫化氢作还原剂,二氧化硫作氧化剂,表现氧化性;
故答案为:氯水褪色;SO2+Cl2+2H2O═2HCl+H2SO4;高锰酸钾褪色;还原;生成浅黄色沉淀;氧化.
点评 本题考查了浓硫酸的化学性质、二氧化硫的性质及检验方法,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意掌握浓硫酸的化学性质


科目:高中化学 来源: 题型:选择题
| A. | 采用加热蒸干高锰酸钾溶液的方法获得高锰酸钾晶体 | |
| B. | 过滤时,为了加快过滤速率,可用玻璃棒在漏斗内搅拌 | |
| C. | 用冷却结晶法提纯含有少量氯化钠杂质的硝酸钾固体 | |
| D. | 某无色溶液中加入稀盐酸无现象,再加Ba(NO3)2溶液,产生白色沉淀,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | .①②④ | C. | ②③④ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com