
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)= mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。

① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+ == Fe2+ + Cu、 、 。
② 试剂B是 。
③ 操作③是蒸发浓缩、冷却结晶、 ,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是 。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是 mol。
【答案】(1)0.01
(2)① Fe +2Fe3+ == 3Fe2+ Fe +2H+ == Fe2+ +H2↑ ② 硫酸 ③ 过滤
④ 取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽
⑤ FeSO4有还原性,易被氧化(或FeSO4·7H2O失去结晶水)⑥ 12
【解析】
试题(1)根据电荷守恒知,c(H+)+3 c(Fe3+)+2 c(Cu2+ )+ c(Na+)= c(OH-)+2 c(SO42-),废水呈强酸性,氢氧根浓度很小,计算时可忽略,代入题给数据计算得c(H+)=0.01 mol/L;
(2) ① 工业废水中含有硫酸铜、硫酸铁和硫酸,加入铁粉后,反应的离子方程式为:Fe + Cu2+ == Fe2+ + Cu、Fe +2Fe3+ == 3Fe2+ 、Fe +2H+ == Fe2+ +H2↑。② 过滤,固体C为铁和铜的混合物,加入过量硫酸,过滤,得铜和硫酸亚铁溶液,故试剂B是硫酸。③ 操作③是从溶液中获得晶体的操作,为蒸发浓缩、冷却结晶、过滤,最后用少量冷水洗涤晶体,在低温下干燥。④Fe3+的检验用KSCN溶液,故判断废水中Fe3+是否除尽,实验方法是取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽。⑤ Fe2+易被氧化,绿矾晶体易失去结晶水,故FeSO4·7H2O需密闭保存,原因是FeSO4有还原性,易被氧化(或FeSO4·7H2O失去结晶水)。⑥ 1000 L废水中n(Fe3+)=2mol,560g铁粉的物质的量为10mol,根据铁元素守恒知,经上述处理,可获得 FeSO4·7H2O的物质的量是12mol。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要90mL 2.0 mol·L-1的Na2CO3溶液,现用无水碳酸钠粉末配制。请回答下列问题:
(1)根据实验要求,选择实验仪器:________________
A.50mL容量瓶; B.100mL容量瓶; C.玻璃棒;
D.100mL量筒; E.托盘天平; F.药匙
(2)若要实施配制,除上述仪器外,尚缺的仪器是 ______________________。
(3)容量瓶在使用前必须进行的操作是__________________________。
(4)计算需要的无水碳酸钠的质量(要有计算过程)___________
(5)配制过程简述为以下各步:其正确的操作顺序为___________________ (填各步骤序号)。
A.冷却至室温; B.洗涤并移液; C.称取; D.溶解; E.摇匀装瓶; F.定容; G.移液
(6)在配制过程中,下列情况对浓度有何影响?
①容量瓶用蒸馏水洗净后,没等到干燥,就移入溶液定容,则所配溶液的浓度___________ (填“偏高”或“偏低”或“无影响”,下同);
②转移溶液时,不小心有溶液溅在瓶外,则所配溶液的浓度________________
③定容时若俯视刻度线,则所配溶液的浓度________________
④若在滴加蒸馏水时,不慎超过了刻度线,则所配溶液的浓度______此时应如何处理?_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。某兴趣小组同学采用镁屑与液溴为原料制备无水MgBr2,设计装置如图所示。已知:Mg与Br2反应剧烈放热;MgBr2具有强吸水性。下列说法正确的是( )

A.冷凝管中冷水进、出口方向错误
B.实验中可以用干燥的空气代替干燥的N2
C.为防止反应过于剧烈,不能用装置C代替装置B
D.装有无水CaCl2固体A的作用是吸收挥发的溴蒸气,防止污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热 42g NaHCO3 和 Na2CO3 固体混合物,至没有气体放出时,剩余的固体质量是 35.8 g。那么原固体混合物中Na 2CO3 的质量是
A. 25.2g B. 16.8 g C. 10.6 g D. 24.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如图所示。

请回答下列问题:
(1)步骤I中发生反应的化学方程式_______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果_______;若步骤II中浸出剂为硫酸,写出Co2O3与硫酸反应的化学方程式______。
(3)步骤Ⅲ中①的目的是除去Al3+,②的目的是除去Li+,写出除去Li+的离子方程式_______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_______、过滤、洗涤、干燥。用75%酒精代替蒸馏水洗涤,其优点是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
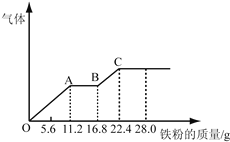
A. 混合酸中HNO3物质的量浓度为2mol/L
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 原混合酸中H2SO4物质的量为0.4 mol
D. 第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是某化学课外活动小组配制500mL3.5mol·L-1NaOH溶液的操作。
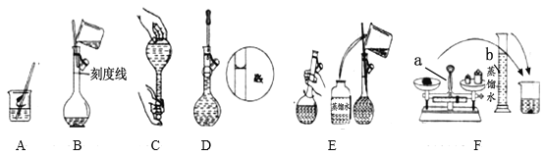
(1)请写出下列仪器的名称:仪器a___,仪器b ___。
(2)配制溶液时,所用容量瓶上标有的数据为___。
(3)在配制过程中,玻璃棒所起的作用有___。
(4)容量瓶使用前,要检验是否漏水,检验是否漏水的实验操作为___。
(5)请你按照配制一定物质的量浓度溶液的具体操作排出操作的顺序:
以上步骤中,正确的操作步骤顺序为F→ → → → → (填序号)。___。
(6)上述操作的图示中存在错误的是___(填序号,用大写字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴(8分)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
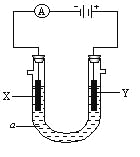
①电解池中X极上的电极反应式是 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式是 ,
检验该电极反应产物的方法是 。
⑵(6分)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是
②Y电极的材料是 ,电极反应式是
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com