
【题目】实验室配制一定物质的量浓度的溶液,一定要用到的一组仪器是( )
A. 托盘天平、药匙、烧杯、容量瓶
B. 量筒(或滴定管、移液管)、容量瓶
C. 容量瓶、烧杯、玻璃棒、胶头滴管
D. 容量瓶、烧杯、玻璃棒、分液漏斗
科目:高中化学 来源: 题型:
【题目】铁、钴(Co)、镍(Ni)是同族元素,它们的化合物在工业上有重要的应用。
(1)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3+(aq)+SCN-(aq) ![]() Fe(SCN)2+(aq)(忽略其它过程)。
Fe(SCN)2+(aq)(忽略其它过程)。
平衡浓度c[Fe(SCN)2+]与温度T的关系如图所示:
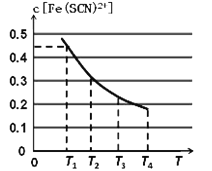
则该反应△H____0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平c[Fe(SCN)2+]=0.45 mol/L,求达到平衡时的平均反应速率v(SCN-)=____mol·L-1·S-1,该温度下的Fe3+的平衡转化率为_____,该温度下反应的平衡常数为__________。
(2)草酸钴(CoC2O4)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:______________________。
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,已知Ksp[Co(OH)2]=6.0×10﹣15,Ksp[Ni(OH)2]=2.0×10﹣15,当Co(OH)2开始沉淀时,溶液中![]() 的值等于______。(取两位有效数字)
的值等于______。(取两位有效数字)
(4)CoxNi(1-x)Fe2O4 (其中Co、Ni均为+2价)可用作H2O2分解的催化剂,具有较高的活性。两种不同方法制得的催化剂在10℃时催化、分解6%的H2O2溶液的相对初始速率随x变化的曲线如图所示。
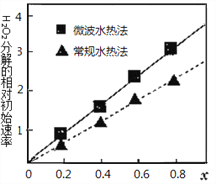
由图中信息可知:__________法制取得到的催化剂活性更高;Co2+、Ni2+ 两种离子中催化效果较好的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法正确的是( )
A. 大量使用薪柴为燃料,践行低碳生活
B. “雾霾天气”、“温室效应”、“光化学烟雾”的形成均与氮的氧化物无关
C. 工业上常用SO2来漂白纸浆、毛、丝等,此外SO2还可以用于杀菌、消毒
D. CO2或SO2的排放是形成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在葡萄糖溶液中有一种环状结构的葡萄糖分子(分子式C6H12O6),且有下列平衡关系:
(1)这种环状结构的分子是通过链式葡萄糖分子中的__________基和___________基通过_______________________反应而形成的。
(2)用(1)反应方式写出由两种简单的有机物合成某一链状醇醚(如右)的反应方程式:________
![]()
(3)已知溴水(Br2+H2O)可以将多羟基醛基氧化成羧基。写出溴水与葡萄糖反应的化学方程式_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油加工的各种处理过程中,属于裂化过程的是( )
A. 分离出汽油和煤油B. 原油脱盐、脱水
C. 十六烷变为辛烷和辛烯D. 将直链烃变为芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某绿色农药结构简式为 ,回答下列问题。
,回答下列问题。
(1)N元素的基态原子核外有_____种空间运动状态的电子,该农药组成元素中,第一电离能较大的前三种元素是(按由大到小顺序排列)________(用元素符号回答,下同),基态硒原子的价层电子排布式为___________。
(2)该物质中,中心原子杂化轨道类型为sp2的原子有_____,分子中编号为① 的碳原子和与其成键的另外几个原子构成的空间结构为_________。
(3)碳、氢、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三种物质的沸点高低顺序为CH42H63OH,其原因是________,三种物质中属于极性分子的物质是______, 与CH4互为等电子体的一种微粒是_________。
(4)硒化锌的晶胞结构如图所示,则硒的配位数为________,若晶胞边长为d pm ,设阿伏加德罗常数的值为NA,则硒化锌的密度为______(不必化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是___________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):______>_____;比较g、h的最高价氧化物对应水化物的酸性强弱:______>______。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com