
| A. | Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | 重结晶是提纯固体的常用方法,碘单质亦可在水溶液中通过重结晶提纯 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
分析 A、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强以及强酸制弱酸;
B、氢氧化铁胶体为红褐色液体;
C、碘易溶于有机溶剂,常用萃取法提纯碘;
D、硝酸可以将亚硫酸钡氧化为硫酸钡.
解答 解:A、Na2SiO3溶液与SO3的反应,说明酸性H2SiO3比H2SO4弱,可用于推断Si与S的非金属性强弱,故A正确;
B、氢氧化铁胶体为红褐色液体,透明,能发生丁达尔现象,故B错误;
C、碘易溶于有机溶剂,常用萃取法提纯碘,不可在水溶液中通过重结晶提纯,故C错误;
D、SO2和SO3混合气体通入Ba(NO3)2溶液只能得到BaSO4的沉淀,故D错误.
故选A.
点评 本题综合考查元素周期律的应用、硝酸的氧化性以及胶体的性质等知识,属于综合知识的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2所包含的阴阳离子个数比为1:1 | |
| B. | 标准状况下,78gNa2O2与44.8CO2反应转移电子数为NA | |
| C. | 等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2足量不同 | |
| D. | 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A. | 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2) | |
| B. | 平衡时,Ⅰ、Ⅱ中上述正反应的平衡常数K(Ⅰ)=2K(Ⅱ) | |
| C. | 平衡后,向两容器中分别再充入一定量的NO2,(Ⅰ)中$\frac{c({N}_{2}{O}_{4})}{c(N{O}_{2})}$的值减小,(Ⅱ)$\frac{c({N}_{2}{O}_{4})}{c(N{O}_{2})}$ 的值增大 | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙酸分子的σ键有7NA | |
| B. | 11.2 L乙烯完全燃烧转移电子数为6.0NA | |
| C. | 88.0g 干冰中含有的电子对数为8.0NA | |
| D. | 1.2g 金刚石中含有的碳碳键数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
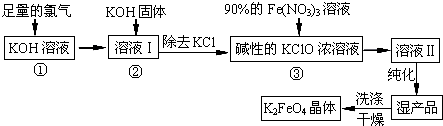
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com