

分析 (1)①打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O;打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O;
②依据实验产生的气体是二氧化硫与空气的密度比较分析,确定收集实验中产生的气体的装置中导气管的位置;
(2)①用排水法测定SO2的量必须做到不能在测量时损耗,需用饱和饱和亚硫酸氢钠溶液;
②根据指示剂的显色范围为:甲基橙:红-3.1-橙-4.4-黄,石蕊:红-5-紫-8-蓝,根据准确判断反应终点分析判断,若耗去a mol/L氢氧化钠溶液b mL,根据H2SO4+2NaOH=Na2SO4+2H2O计算原余酸的物质的量,注意体积的变化.
解答 解:(1)①打开活塞a之前,浓硫酸和Cu在加热条件下发生氧化还原反应生成CuSO4、SO2和H2O,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
打开活塞a后,Cu、O2和稀硫酸反应生成CuSO4和H2O,反应方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;2Cu+2H2SO4+O2=2CuSO4+2H2O;
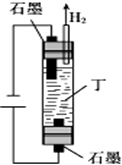
②铜跟浓硫酸反应生成了二氧化硫气体,二氧化硫密度比空气大,可以用向上排气法收集,所以装置中的导气管应长进短出,装置图为 ,
,
故答案为: ;
;
(2)①测定SO2的量必须准确测定无气体损耗,用排水法测定装置A产生气体的体积,实验方案中D装置中的试剂应满足不反应且在其中溶解度度较小,二氧化硫在饱和NaHSO3溶液中的溶解度降低,所以可用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,
故答案为:饱和NaHSO3;
②由于Cu(OH)2开始沉淀的pH约为5,应选择变色范围接近的指示剂,以减小滴定误差,故选择甲基橙作指示剂,若用酚酞作指示剂时溶液中的Cu 2+会和NaOH反应,Cu(OH)2的蓝色会干扰滴定终点的正确判断,
设余酸的物质的量为n,消耗NaOH的物质的量为:a mol/L×b×10-3 L=ab×10-3 mol,H2SO4+2NaOH=Na2SO4+2H2O
1 2
n×$\frac{20}{100}$ ab×10-3 mol n=$\frac{5ab×1{0}^{-3}}{2}$mol,
故答案为:甲基橙;Cu(OH)2开始沉淀的pH约为5,若用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu(OH)2的蓝色会干扰滴定终点的正确判断; $\frac{5ab×1{0}^{-3}}{2}$.
点评 本题以铜和浓硫酸反应实验为载体考查性质实验方案设计,涉及实验方案的设计与评价、化学方程式的书写等知识点,明确实验原理是解本题关键,难点是实验方案的评价,易错点是化学用语的正确使用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
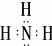 ,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.
,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
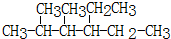 2,3-二甲基-3-乙基己烷
2,3-二甲基-3-乙基己烷 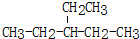 2-乙基戊烷
2-乙基戊烷查看答案和解析>>
科目:高中化学 来源: 题型:实验题
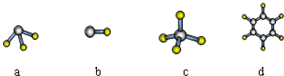
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可选用酚酞作指示剂,溶液由红色变为无色 | |
| B. | 可选用酚酞作指示剂,溶液由无色变为红色 | |
| C. | 可选用甲基橙作指示剂,溶液由黄色变为橙色 | |
| D. | 可选用甲基橙作指示剂,溶液由橙色变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同种元素的原子 | B. | 不同种分子 | ||
| C. | 一种是分子,另一种是离子 | D. | 一种是分子,另一种是原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 药品橱 | 甲 | 乙 | 丙 | 丁 |
| 药品 | 锌、铜 | 硫酸钠 | 氢氧化钠 | 盐酸 |
| 铁、镁 | 碳酸钠 | 氢氧化钾 | 稀硫酸 |
| A. | 甲橱 | B. | 乙橱 | C. | 丙橱 | D. | 丁橱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com