
【题目】已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可做钡餐,BaCO3不能作钡餐的主要理由是( )
A. BaSO4的溶度积常数比BaCO3的小
B. SO![]() 没有毒性,CO
没有毒性,CO![]() 有毒性
有毒性
C. BaSO4的密度大
D. 胃酸能与CO![]() 结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】下列化学键中,都属于极性共价键的是( )
A.共价化合物中的化学键
B.离子化合物中的共价键
C.同种元素原子间的共价键
D.不同元素原子间的共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的反应不能通过一步反应实现的是( )
A.Na2CO3→NaClB.NaCl→ NaOH
C.NaOH→NaClD.CuO→Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关丙烯(CH3CH=CH2)的结构或性质叙述中不正确的是
A. 分子中所有碳原子都在同一平面上
B. 能使溴水褪色
C. 能使酸性高锰酸钾溶液褪色
D. 与氯化氢发生加成反应只能生成一种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M为短周期主族元素,25°C时,其最高价氧化物对应的水化物(浓度均为 0.01mol.L-1)溶液的pH和原子半径的关系如图所示。下列有关说法不正确的是
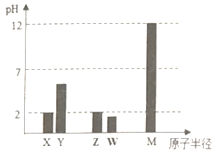
A. Y的最高价氧化物的电子式为:![]()
B. 最简单气态氢化物的热稳定性:Z>W
C. X、M两种元素形成的简单离子半径大小顺序:X<M
D. X的氢化物与Z的氢化物反应后生成的化合物中既含离子键又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L稀硫酸100 mL。
(1)实验操作:
a.用100mL量筒量取98%的浓硫酸___________mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线1~2 cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用。
(2)实验
①正确的操作步骤是__________________________________________________(填序号)。
②此实验中玻璃棒的作用是__________________________________________________。
③实验操作中有两处错误,这两处错误是:________________________、_________________________。
(3)下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
①量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中______________。
②定容时俯视容量瓶刻度线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石(主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O,含 SiO2、FeCO3、 Fe2O3等杂质)为原料制备CuCl2的工艺流程如下:
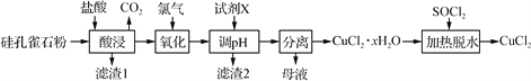
(1)为提高“酸浸”时铜元素的浸出率,可以采取的措施有:
①适当加快搅拌速率;②______________。(任答一点即可)
(2)“氧化”时发生反应的离子方程式为__________。
(3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为______(填化学式);试剂X可选择_____(填字母)。
a. Cu b. NaOH c. Cu(OH)2 d.氨水
(4)“调pH”时,pH不能过高,其原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)维生素C又称为抗坏血酸,在人体内有重要的功能。例如,帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+。这说明维生素C具有________(填“氧化性”或“还原性”)。
(2)2Na+O2![]() Na2O2反应中,
Na2O2反应中,
①________被氧化,________是氧化剂,氧化产物是_______,过氧化钠中氧元素的化合价是_______。
②此反应中若转移了2 mol的电子,则需要氧气________ mol。
③用单线桥或双线桥法表示反应中电子转移的方向和数目:______________________。
(3)根据反应①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是____________。
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com