
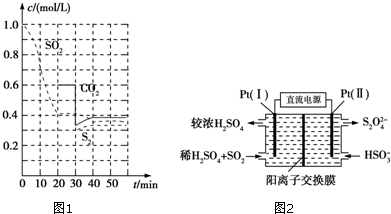
分析 Ⅰ.已知①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根据盖斯定律:③×2-①-②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)据此计算;
Ⅱ.(1)①根据v=$\frac{△c}{△t}$计算v(SO2);
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度;
③平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$计算,注意固体和纯液体不写入表达式;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠;
②a.根据电荷守恒判断;
b.根据物料守恒判断;
c.NaHSO3溶液中HSO3-的电离程度大于其水解程度;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度;
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸;
②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4H+,根据电子转移守恒计算生成硫酸根、氢离子的物质的量,为保持溶液电中性,多余的氢离子通过阳离子交换膜移至右侧,左侧溶液中增加离子为生成硫酸电离的离子总量.
解答 解:Ⅰ.已知①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根据盖斯定律:③×2-①-②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=(-221)×2-(+460)-(+571.2)=-1473.2KJ•mol-1,
故答案为:-1473.2KJ•mol-1;
Ⅱ.(1)①由图可知,0-20min内二氧化硫浓度变化量为1mol/L-0.4mol/L=0.6mol/L,故v(SO2)=$\frac{0.6mol•{L}^{-1}}{20min}$=0.03mol/(L•min),
故答案为:0.03mol/(L•min);
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度,
故答案为:减少CO2的浓度;
③恒温恒容时2C(s)+2SO2(g)?S2(g)+2CO2(g),平衡常数K=$\frac{c({S}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(S{O}_{2})}$=$\frac{0.3×0.{6}^{2}}{0.{4}^{2}}$=0.675,
故答案为:0.675;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠,反应离子方程式为:SO32-+SO2+H2O=2HSO3-,
故答案为:SO32-+SO2+H2O=2HSO3-;
②a.根据电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故溶液中c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),故a正确;
b.溶液中S元素以SO32-、HSO3-、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO4),故b正确;
c.NaHSO3溶液中HSO3-的电离程度大于其水解程度,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-),故c正确;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度,故d错误,
故答案为:abc;
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸,电极反应式为:SO2-2e-+2H2O=SO42-+4H+,
故答案为:SO2-2e-+2H2O=SO42-+4H+;
②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4 H+,根据电子转移守恒,生成硫酸根物质的量$\frac{0.02mol}{2}$=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol,
故答案为:0.03.
点评 本题属于拼合型题目,涉及反应热计算、反应速率计算、化学平衡影响因素、离子浓度比较、电极反应式书写、电解池有关计算等,需要学生具备扎实的基础,侧重考查学生对知识的迁移应用,(3)中左侧溶液中增加离子物质的量计算为易错点,学生容易根据电极反应式计算,忽略部分氢离子移至右侧,题目综合性强.


科目:高中化学 来源: 题型:选择题
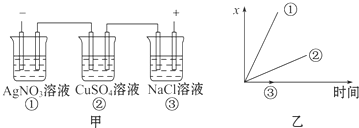
| A. | 各电解池析出气体体积总数的变化 | B. | 各电解池阳极质量的增加 | ||
| C. | 各电解池阴极质量的增加 | D. | 各电极上放电的离子总数的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
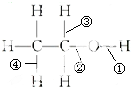
| A. | 乙醇与金属钠反应断裂②键 | B. | 乙醇与溴化氢反应断裂①键 | ||
| C. | 乙醇催化氧化变乙醛断裂①③键 | D. | 乙醇分子内脱水断裂①③键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•(L•min)-1 | B. | v(B)=0.4mol•(L•s)-1 | ||
| C. | v(B)=0.3mol•(L•s)-1 | D. | v(C)=0.2mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
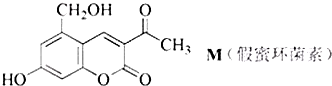
| A. | 在镍作催化剂并加热的条件下,1molM最多可与6molH2发生加成反应 | |
| B. | M不可能使酸性KMnO4溶液褪色 | |
| C. | M可在热的NaOH溶液中发生反应,最多可消耗3molNaOH | |
| D. | 1molM最多可与2molBr2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
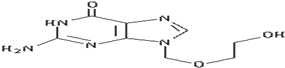 阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )
阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )| A. | ①②③④⑥⑧ | B. | ②④⑤⑥ | C. | ③④⑥⑧ | D. | ④⑥⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com