
| A. | 三种一元弱酸HX、HY、HZ,其电离平衡常数依次减小,则同体积同pH的对应钠盐溶液中,水的电离度大小是NaX>NaY>NaZ | |
| B. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)=c( H+)+c(CH3COOH) | |
| C. | 0.1mol/LNaHS溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c( S2-)>c(HS-)>c(OH-) | |
| D. | 向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)=c( SO42-)>c(NH4+)>c(H+)=c(OH-) |
分析 A.酸的电离平衡常数越小,其对应的酸根离子水解程度越大,酸根离子水解程度越大导致其钠盐溶液中水的电离程度越大;
B.醋酸和NaOH的浓度相等体积相等,所以其物质的量相等,二者恰好反应生成醋酸钠,根据质子守恒判断;
C.NaHS、NaOH的物质的量浓度、体积相等,所以其物质的量相等,二者恰好反应生成硫化钠和水,S2-水解导致溶液呈碱性,S2-两步水解都生成OH-;
D.混合溶液呈中性,则存在c(H+)=c(OH-),如果二者以1:1反应,混合溶液中溶质为Na2SO4、(NH4)2SO4,溶液呈酸性,要使混合溶液呈碱性,二者之比应该小于1:1,结合物料守恒判断.
解答 解:A.酸的电离平衡常数越小,其对应的酸根离子水解程度越大,酸根离子水解程度越大导致其钠盐溶液中水的电离程度越大,酸的电离平衡常数HX>HY>HZ,酸根离子水解程度X-<Y-<Z-,所以水的电离程度NaX<NaY<NaZ,故A错误;
B.醋酸和NaOH的浓度相等体积相等,所以其物质的量相等,二者恰好反应生成醋酸钠,根据质子守恒得c(OH-)=c( H+)+c(CH3COOH),故B正确;
C.NaHS、NaOH的物质的量浓度、体积相等,所以其物质的量相等,二者恰好反应生成硫化钠和水,S2-水解导致溶液呈碱性,S2-两步水解都生成OH-,所以存在c(HS-)<c(OH-),离子浓度大小顺序是
c(Na+)>c( S2-)>c(OH-)>c(HS-),故C错误;
D.混合溶液呈中性,则存在c(H+)=c(OH-),如果二者以1:1反应,混合溶液中溶质为Na2SO4、(NH4)2SO4,溶液呈酸性,要使混合溶液呈碱性,二者之比应该小于1:1,结合物料守恒得c(Na+)>c( SO42-)>c(NH4+)>c(H+)=c(OH-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,涉及盐类水解、弱电解质的电离,明确混合溶液中溶质及其性质是解本题关键,注意守恒思想的正确运用,易错选项是D,D选项采用逆向思维方法解答,题目难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
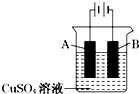 钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.
钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
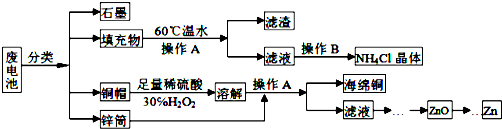
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用草酸钠标定高锰酸钾溶液的实验中,滴定终点的判断为:当滴入最后一滴高锰酸钾溶液时,溶液由无色变为浅紫色,且半分钟内不褪色 | |
| B. | 探究“影响硫代硫酸钠与稀硫酸反应速率的因素”的实验中,需要用到的计量仪器只需量筒、温度计 | |
| C. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,振荡,静置、分液,得下层液体 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
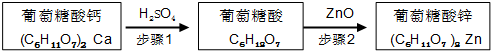
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
 请回答下列问题:
请回答下列问题: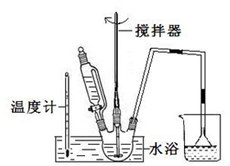
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | FeCl2溶液 | C. | FeCl3溶液 | D. | Fe(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com