
下列说法正确的是:
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.在0.1mol/LNa2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32﹣)减小
C.0.1mol·L﹣1NH4C1溶液与0.05mol·L﹣1 NaOH溶液等体积混合溶液中离子浓度:
c(Cl﹣)>c(NH4+)>c(Na+)>c(OH﹣)
D.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a一定小于b
C
【解析】
试题分析:A.如在NaAc溶液中由于该盐是强碱弱酸盐,会发生水解反应:Ac-+H2O HAc+OH-。溶液显碱性。因此在常温下醋酸分子也可能存在于pH>7的碱性溶液中。错误。B.在0.1mol/LNa2SO3的溶液中存在水解平衡:SO32-+H2O
HAc+OH-。溶液显碱性。因此在常温下醋酸分子也可能存在于pH>7的碱性溶液中。错误。B.在0.1mol/LNa2SO3的溶液中存在水解平衡:SO32-+H2O HSO3-+OH-;HSO3-+H2O
HSO3-+OH-;HSO3-+H2O H2SO3+OH-;当加入少量NaOH固体,c(OH-)、c(Na+)都增大,平衡逆向移动,所以c(Na+)增大,c(SO32﹣)也增大。错误。C.0.1mol·L﹣1NH4C1溶液与0.05mol·L﹣1 NaOH溶液等体积混合得到的溶液为NH4C1、NH3·H2O、NaCl等浓度的混合溶液。根据物料守恒可得c(Cl﹣) >c(Na+);由于NH4+的水解作用大于NH3·H2O的电离作用,所以c(NH4+)>c(Na+),盐的电离作用强于弱电解质NH3·H2O的电离作用,所以c(Na+)>c(OH﹣)。因此在溶液中的两种浓度关系为:c(Cl﹣)>c(NH4+)>c(Na+)>c(OH﹣)。正确。D.HCN 是弱酸,NaOH是强碱。若二者恰好中和,则得到NaCN溶液中由于CN-水解消耗,所以c(Na+)>c(CN﹣)。因此a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a不一定小于b。错误。
H2SO3+OH-;当加入少量NaOH固体,c(OH-)、c(Na+)都增大,平衡逆向移动,所以c(Na+)增大,c(SO32﹣)也增大。错误。C.0.1mol·L﹣1NH4C1溶液与0.05mol·L﹣1 NaOH溶液等体积混合得到的溶液为NH4C1、NH3·H2O、NaCl等浓度的混合溶液。根据物料守恒可得c(Cl﹣) >c(Na+);由于NH4+的水解作用大于NH3·H2O的电离作用,所以c(NH4+)>c(Na+),盐的电离作用强于弱电解质NH3·H2O的电离作用,所以c(Na+)>c(OH﹣)。因此在溶液中的两种浓度关系为:c(Cl﹣)>c(NH4+)>c(Na+)>c(OH﹣)。正确。D.HCN 是弱酸,NaOH是强碱。若二者恰好中和,则得到NaCN溶液中由于CN-水解消耗,所以c(Na+)>c(CN﹣)。因此a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a不一定小于b。错误。
考点:考查盐的水解、离子浓度的比较、外界条件对盐水解因素的影响的知识。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
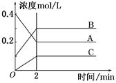
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
2014年世界环境日中国主题为“向污染宣战”,下列有关环境污染的叙述错误的是( )
A.大气污染主要指CO、SO2、氮氧化物以及粉尘等
B.氮氧化物是造成光化学烟雾的主要原因
C.臭氧可以杀菌消毒,空气中的臭氧含量越高,对人体健康越有利
D.酸雨通常是指pH在5.6以下的降水
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:选择题
在一定条件下,将E(g)和F(g)充入体积不变的2 L密闭容器中,发生下述反应,并于5 min末达到平衡:2E(g)+F(g) 2G(g)。有关数据如下:
2G(g)。有关数据如下:
| E(g) | F(g) | G(g) |
初始浓度(mol?L-1) | 2.0 | 1.0 | 0 |
平衡浓度(mol?L-1) | c1 | c2 | 0.4 |
下列判断正确的是
A.反应在前5min内,v(E)=0.04 mol/(L·min)
B.其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大
C.其他条件不变,降低温度,平衡时n(E)=3.0mol,则反应的△H>0
D.平衡后移走2.0 mol E和1.0 mol F,在相同条件下再达平衡时,c(G)<0.2 mol?L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:简答题
(14分)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:

回答下列问题:
(1)在反应器中发生反应的化学方程式是______________。
(2)在膜反应器中发生反应:2HI(g)  H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:

①该温度下,反应平衡常数K=_______,若升高温度,K值将_______
(填“增大”、“减小”或“不变?’)。
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是___________________
(3)电渗析装置如下图所示:

①结合电极反应式解释阴极区HIx转化为HI的原理是______________________________
②该装置中发生的总反应的化学方程式是________________________
(4)上述工艺流程中循环利用的物质是_________。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
下列说法错误的是;
A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
B.硅酸盐NaAlSiO4·nH2O可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O
C.Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大
D.过量铁与浓硫酸加热反应可以得到氢气
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:选择题
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是

A.核磁共振氢谱峰数相同
B.均能发生加成反应、取代反应、消去反应
C.两种分子中所有碳原子不可能在同一个平面内
D.可用FeCl3溶液鉴别
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:简答题
(13分)有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4且A不能使Br2的CCl4溶液褪色;1molB反应生成了2molC.

请回答下列问题:
(1)C→E的反应类型为____________
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.0%,则由A合成H的总产率为____________
(3)A的结构简式为___________________·
(4)写出C与银氨溶液反应的离子方程式为____________________________________
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为__________________
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+ 2Pb2+(aq)+ H2O(l) 2PbCrO4(s)+ 2H+(aq)△H<0
2PbCrO4(s)+ 2H+(aq)△H<0
该反应达平衡后,改变条件,下列说法正确的是
A.移走部分PbCrO4固体,Cr2O72-转化率升高
B.升高温度,该反应的平衡常数(K)增大
C.加入少量NaOH固体,自然沉降后,溶液颜色变浅
D.加入少量K2Cr2O7固体后,溶液中c(H+)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com