
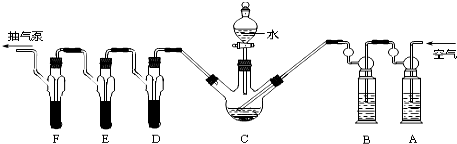
分析 (1)PH3具有较强的还原性,可用KMnO4和Na2SO3测定,根据题意可知该实验的目的是对粮食中残留磷化物含量进行测定;
(2)磷化铝能与水或酸反应产生有毒气体膦(PH3),与水反应结合水的结构可知磷化铝能与水反应生成氢氧化铝和PH3;
(3)利用连续装置特征,结合气体压强变化,可以利用抽气泵抽气观察各装置中气体的产生,若有气泡冒出,证明气密性完好;也可以从A装置鼓入空气,观察各装置中若均有气泡产生,则气密性良好,反之不好;
(4)高锰酸钾溶液是强氧化剂可以吸收还原性气体;碱性焦性没食子酸溶液,焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧;
(5)依据消耗的亚硫酸钠物质的量结合定量关系计算剩余高锰酸钾,计算吸收PH3需要的高锰酸钾物质的量,进一步计算PH3物质的量,得到PH3含量.
解答 解:(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,可用KMnO4和Na2SO3测定粮食中残留磷化物含量;安装蒸馏吸收装置,A、D、E、F各装1.00mL浓度为5.00×10-4mol/L的酸性KMnO4溶液,B中装碱性焦性没食子酸(1,2,3-三羟基苯),C中装200g原粮,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,然后用高锰酸钾滴定测定PH3,然后用Na2SO3标准溶液滴定剩余的KMnO4溶液,可得磷化物含量,
故答案为:粮食中残留磷化物的定量测定;
(2)依据题干信息,磷化铝和水反应,水解生成PH3和氢氧化铝,反应的化学方程式为:AlP+3H2O=Al(OH)3↓+PH3↑,
故答案为:AlP+3H2O=Al(OH)3↓+PH3↑;
(3)利用连续装置特征,结合气体压强变化,可以利用抽气泵抽气观察各装置中气体的产生,若有气泡冒出,证明气密性完好;
故答案为:打开抽气泵抽气,观察各装置中是否有气泡产生;
(4)依据装置图中装置中的试剂选择分析判断,高锰酸钾溶液是强氧化剂可以吸收空气中的还原性气体;焦性没食子酸先和碱反应,再和氧气反应可以吸收氧气;若不吸收氧气,PH3会在氧气中燃烧,用滴定方法测定的PH3减小,结果偏低;
故答案为:还原性;除去空气中的O2;偏低;
(5)加水稀释至25mL,用浓度为5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL;依据滴定反应:2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O可得,剩余高锰酸钾的物质的量=0.011L×2.5×10-4mol/L×$\frac{2}{5}$=1.1×10-6mol;与PH3反应的高锰酸钾的物质的量=0.003L×5.00×10-4mol/L-1.1×10-6mol=4.0×10-7mol;根据化学方程式 5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O计算得到PH3的物质的量=4.0×10-7mol×$\frac{5}{8}$=2.5×10-7mol;故该原粮中磷化物的含量为$\frac{2.5×1{0}^{-7}mol×34g/mol×1000mg/g}{0.2kg}$=0.0425mg/kg.
故答案为:0.0425.
点评 本题以粮食中残留磷化氢的定量测定为命题背景,考查元素化合物知识氧化还原反应滴定及相关计算,综合考查了水解方程式的书写、非常规装置气密性的检验方法、实验原理的理解和定量测定的有关计算和误差分析等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1gH2所含分子数为N0 | |
| B. | 2g D2O中所含的质子数为N0 | |
| C. | 0.5mol/L Na2SO4溶液中所含Na+数为N0 | |
| D. | 标准状况下,4.48 LCCl4所含原子数为N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R2O | B. | R2O3 | C. | R2O5 | D. | RO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 化学事实 | 类推结论 | |
| A | pH=3盐酸稀释1000倍后pH=6 | pH=6盐酸稀释1000倍后pH=9 |
| B | 用电解熔融MgCl2制取金属Mg | 用电解熔融NaCl冶炼金属钠 |
| C | Na着火不能用干冰灭火 | K着火不能用干冰灭火 |
| D | 将SO2通入BaCl2溶液无沉淀生成 | 将SO2通入Ba(NO3)2溶液也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解和油脂皂化都有高分子生成小分子的过程 | |
| B. | 正戊烷、异戊烷、新戊烷的沸点逐渐升高 | |
| C. | 蔗糖和麦芽糖水解前后均可发生银镜反应 | |
| D. | CH3-CH=CH-C≡C-CF3分子6个碳原子一定共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com