
| A. | 滴定管用水洗后,未用标准溶液润洗就装入标准溶液 | |
| B. | 用于取待测液的滴定管未用待测液润洗 | |
| C. | 在摇动锥形瓶的过程中不慎溅出了一小部分溶液 | |
| D. | 标准液读数时,滴定前仰视,滴定后俯视 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,不当操作导致V(标准)增大时,测定结果偏高,以此判断浓度的误差.
解答 解:A.滴定管用水洗后,未用标准溶液润洗就装入标准溶液,导致标准液浓度减小,所用V(标准)偏大,测定浓度偏高,故A选;
B.锥形瓶盛待测液前,未用待测液润洗,是正确操作,故B不选;
C.在摇动锥形瓶的过程中不慎溅出了一小部分溶液,导致所用标准液体积偏小,测定浓度偏低,故C不选;
D.标准液读数时,滴定前仰视,滴定后俯视,导致所读标准液体积偏小,测定浓度偏低,故D不选;
故选A.
点评 本题主要考查了化学实验操作中的误差分析,题目难度不大,掌握实验的原理及正确的误差分析是解题的关键,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| B. | 能自发进行的反应一定能迅速发生 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独做为判断反应能否自发进行的判据 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都可能自发 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 平行实验编号 | Na2C2O4溶液 (mL) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 20.00 | 0.00 | 21.18 |
| 2 | 20.00 | 1.02 | 21.00 |
| 3 | 20.00 | 1.18 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  | |
| 序号 | a | b | c | d | e | f |
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
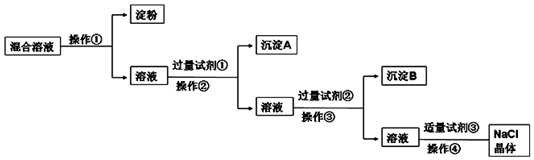
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
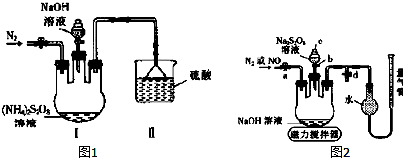
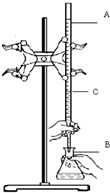 在实验室用已知浓度的盐酸滴定某未知浓度的NaOH溶液,装置和操作如右图所示.请回答:
在实验室用已知浓度的盐酸滴定某未知浓度的NaOH溶液,装置和操作如右图所示.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com