
| A. | 溴水 | B. | 酸性髙锰酸钾溶液 | ||
| C. | 碳酸钠溶液 | D. | 紫色石蕊溶液 |
分析 从水溶性来区分,乙酸和乙醇与水混溶,苯不溶于水,但密度比水小,四氯化碳不溶于水,但密度比水大,在化学性质上乙酸具有酸性,以此解答.
解答 解:A.加入溴水,不能鉴别乙酸、乙醇,故A错误;
B.高锰酸钾可氧化乙醇,溶液褪色,乙酸溶于水,苯不溶于水,但密度比水小,四氯化碳不溶于水,但密度比水大,可鉴别,故B正确;
C.乙醇溶于水,苯不溶于水,但密度比水小,四氯化碳不溶于水,但密度比水大,乙酸与碳酸钠反应生成气体,可鉴别,故C正确;
D.乙酸具有酸性,可使紫色石蕊变红色,乙醇溶于水,苯不溶于水,但密度比水小,四氯化碳不溶于水,但密度比水大,可鉴别,故D正确.
故选A.
点评 本题考查有机物的鉴别,题目难度不大,本题注意乙酸、乙醇以及苯的性质的异同,注意乙酸的酸性以及苯、四氯化碳与水互不相溶的性质.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变时增大压强,能使全气体反应体系中活化分子百分数增加 | |
| B. | 中和反应都是放热反应 | |
| C. | 在FeCl3溶液和KSCN溶液反应的平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | 熵增大的反应不一定自发,但自发反应熵定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 增大B的浓度 | ||
| C. | 增大压强 | D. | 使用合适的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
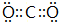 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
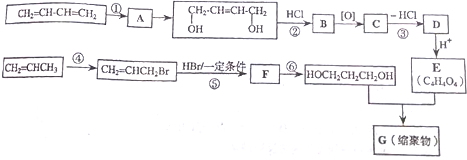
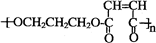 +2nH2O
+2nH2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由三氯化铁到氢氧化铁胶体有发生化学变化发生 | |
| B. | 氢氧化铁胶体溶液的颗粒的直径在10-9~10-7m之间 | |
| C. | 可以用丁达尔效应实验有效鉴别氯化钠溶液和氢氧化铁溶液 | |
| D. | 三氯化铁可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 铝箔在酒精灯火焰上加热融化但不滴落 | 铝箔对熔化的铝有较强的吸附作用 | Ⅰ对;Ⅱ错. |
| C | 铝粉可以和氧化铁粉末发生铝热反应 | 铝热反应是工业炼铁最常用方法 | Ⅰ对;Ⅱ错. |
| D | 铜在潮湿空气中表面会生成铜绿 | 可用铜容器盛放浓硫酸 | Ⅰ对;Ⅱ对. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g乙烯与丙稀的混合物中含有氢原子的数目为NA | |
| C. | 50mL18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com