
【题目】在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
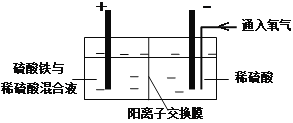
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)![]() R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)
【答案】
(1)①吸收硫化氢气体,防止环境污染;② Fe2+-e-=Fe3+;
(2)分液漏斗;富集Cu2+,分离Cu2+与其他金属阳离子;
(3)增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)![]() R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生;
R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生;
(4)c(H+)>c(SO42-)>c(Cu2+)>c(OH-);
【解析】
试题分析:(1)①由发生的反应可知,Fe3+氧化吸收硫化氢气体,防止环境污染,故答案为:吸收硫化氢气体,防止环境污染;
②Fe3+被还原Fe2+,Fe2+在阳极放电Fe2+-e-=Fe3+,又生成Fe3+,电解过程中,阳极区Fe3+的浓度基本保持不变,故答案为:Fe2+在阳极放电Fe2+-e-=Fe3+,又生成Fe3+;
(2)首先氢离子放电生成氢气,反应一段时间,铜离子放电生成铜,再通入氧气的条件下Cu、氧气、硫酸反应生成硫酸铜,发生的反应依次为:2H++2 e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O,故答案为:2H++2 e-=H2↑、Cu2++2e-=Cu、2Cu+O2+2H2SO4=2CuSO4+2H2O;
(3)有机相和水相不互溶,分离有机相和水相通常利用分液的方法,使用的仪器为分液漏斗;加入有机萃取剂富集Cu2+,分离Cu2+与其它金属阳离子;故答案为:分液漏斗;富集Cu2+,分离Cu2+与其它金属阳离子;
(4)向有机相中加入一定浓度的硫酸,增大H+浓度,使平衡2RH(有机相)+Cu2+(水相) ![]() R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生,故答案为:增大H+浓度,使平衡2RH(有机相)+Cu2+(水相)
R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生,故答案为:增大H+浓度,使平衡2RH(有机相)+Cu2+(水相) ![]() R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生;
R2Cu(有机相)+2H+(水相)逆向移动,Cu2+进入水相得以再生;
(5)电解uSO4溶液,发生反应2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,200mL 0.5mol/L的CuSO4溶液中n(CuSO4)=0.2L×0.5mol/L=0.1mol,生成铜3.2g,物质的量为
2Cu+2H2SO4+O2↑,200mL 0.5mol/L的CuSO4溶液中n(CuSO4)=0.2L×0.5mol/L=0.1mol,生成铜3.2g,物质的量为![]() =0.05mol,故生成H2SO40.05mol,溶液中CuSO4为0.1mol-0.05mol=0.05mol,电解后的溶液为CuSO4、H2SO4混合溶液,溶液呈酸性,溶液中铜离子水解、水发生电离,故n(H+)>0.05mol×2=0.1mol,n(SO42-)=0.1mol,n(Cu2+)<0.05mol,溶液中氢氧根浓度很小,故c(H+)>c(SO42-)>c(Cu2+)>c(OH-),故答案为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
=0.05mol,故生成H2SO40.05mol,溶液中CuSO4为0.1mol-0.05mol=0.05mol,电解后的溶液为CuSO4、H2SO4混合溶液,溶液呈酸性,溶液中铜离子水解、水发生电离,故n(H+)>0.05mol×2=0.1mol,n(SO42-)=0.1mol,n(Cu2+)<0.05mol,溶液中氢氧根浓度很小,故c(H+)>c(SO42-)>c(Cu2+)>c(OH-),故答案为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
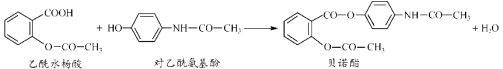
下列有关叙述正确的是
A.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
B.贝诺酯分子中有三种含氧官能团
C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应
D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前七周期所含的元素种数如下表:
周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
由此推测第八周期最多可能含有的元素种数是( )。
A.18 B.32 C.50 D.64
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,则下列说法正确的是
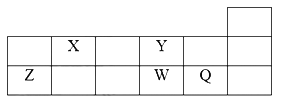
A. W的氧化物对应的水化物为强酸
B. 由Z与Y组成的物质在熔融时不能导电
C. W得电子能力比Q强
D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当三份铜粉分别与足量的稀硝酸、浓硝酸、热的浓硫酸反应后收集到的气体在相同状况下体积相等时,三份铜粉的质量比为
A. 3:1:2 B. 3:2:2 C. 1:1:2 D. 1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2和O2。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
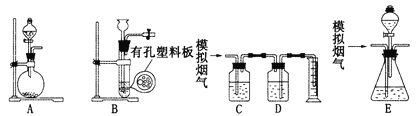
回答下列问题:
I.模拟烟气的制备
(1)用A装置制SO2的化学方程式为______________________________。
(2)用B装置制CO2,使用该装置的优点是___________________________。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
Ⅱ.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,C、D中盛放的药品分别是____、____(填序号):
①KMnO4溶液②饱和NaHSO3溶液③饱和Na2CO3溶液④饱和NaHCO3溶液
(5)若模拟烟气的流速为a mL·min-1,t1 min后,测得量筒内液体的体积为V mL则SO2的体积分数是_______________(写表达式)。
III.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeC12和FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫的目的。写出催化剂参与反应过程的离子方程式:
①SO2+2H2O+2Fe3+==SO42-+2Fe2++4H+;②______________________________。
(7)若模拟烟气仍以a mL· min-1的流速直接通过转化器E装置,t2 min后,向E装置中加入足量的盐酸酸化的BaCl2溶液得到白色浑浊液,经_______、 洗涤、_____、称量,得到m g固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是_________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.离子键只存在于金属阳离子与酸根阴离子之间
B.两种非金属元素形成AB型化合物,它一定含共价键
C.物质中化学键破坏了,一定发生化学变化
D.化学键类型一定由元素类别决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有两瓶失去标签的溶液,其中一瓶是K2SO4溶液,另一瓶是NaOH溶液.鉴别时,下列选用的试纸或试剂不正确的是( )
A.pH试纸
B.紫色石蕊试液
C.Na2CO3固体
D.CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.纯铁比生铁更耐腐蚀
B.明矾水解形成胶体能吸附悬浮物,可用于净水
C.碳酸钠溶液呈碱性是因为其在水中电离出OH-
D.工业废水中的Cu2+和Hg2+可用Na2S或H2S除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com