
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 常温常压下,1.06gNaCO3含有的分子数目为0.02NA | |
| D. | 1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
分析 A.质量转化为物质的量,结合1个水分子含有2个氢原子;
B.依据n=$\frac{V}{22.4L/mol}$计算二氧化碳分子的物质的量,依据N=nNA解答;
C.碳酸钠为离子晶体,不含分子;
D.氯酸钾电离生成钾离子与氯酸根离子.
解答 解:A.18gH2O物质的量为$\frac{18g}{18g/mol}$=1mol,含有的氢原子数目为2NA,故A错误;
B.标准状况下,22.4LCO2物质的量$\frac{22.4L}{22.4L/mol}$=1mol,含有分子数目为NA,故B正确;
C.碳酸钠为离子晶体,不含分子,故C错误;
D.氯酸钾电离生成钾离子与氯酸根离子,不会产生氯离子,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用,物质的量计算微粒数的方法,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| B. | 用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)═Fe(OH)3↓+3H+ | |
| C. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ④ | D. | 均不符合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置是实验室常用的气体制取装置.据图回答下列问题:
如图所示装置是实验室常用的气体制取装置.据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | |
| B. | Fe+2HCl═FeCl2+H2↑ | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | NaOH+HCl=NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若x>z则a>b | B. | x=y>z 则a<b | C. | x=z<y则a=b | D. | x<z=y则a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
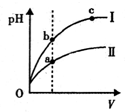
| A. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,K(HF)保持不变 | |
| B. | 等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 | |
| D. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
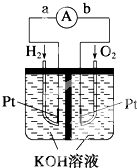 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫元素在自然界中既有游离态,又有化合态 | |
| B. | 浓硫酸不可用来干燥H2S气体,因其具有强氧化性 | |
| C. | 硫单质与铁反应生成硫化铁 | |
| D. | SO2、SO3都为酸性氧化物,都可与水反应生成相应的酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com