
| NO | - 3 |
| 3.2g |
| 64g/mol |
| 0.05mol |
| 0.1L |
| 3.2g |
| 64g/mol |
| 0.05mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、铜与足量的稀硝酸反应生成4.48L气体时,转移的电子数为0.6NA |
| B、将硫溶于热的浓硫酸,当生成3moLSO2时,转移的电子数为4 NA |
| C、常温常压下,4.6g 的NO2和N2O4混合气体含有的原子数为3NA |
| D、标准状况下,22.4 L 氯气与足量的氢氧化钠溶液充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
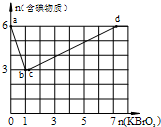 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极,断开S2接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成.一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池.关于该原电池的叙述正确的是( )
如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极,断开S2接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成.一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池.关于该原电池的叙述正确的是( )| A、C(Ⅰ)的电极名称是负极 |
| B、C(Ⅱ)的电极名称是阳极 |
| C、C(Ⅰ)的电极反应式是2H++2e一=H2↑ |
| D、C(Ⅱ)的电极反应式是Cl2+2e-=2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水.当K闭合后,在交换膜处SO42-从右向左移动.下列分析不正确的是( )
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水.当K闭合后,在交换膜处SO42-从右向左移动.下列分析不正确的是( )| A、溶液中c(A2+)增大 | ||||
| B、B的电极反应:B2++2e-═B | ||||
| C、y电极上有Cl2产生,发生氧化反应 | ||||
D、右边装置反应的离子方程式为:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL lmol?L-1Na2CO3溶液中溶质离子的总数为0.3NA | |||||||||||
B、若120g的墨粉(只含碳)能打a个字,则平均每个字约含有
| |||||||||||
C、25℃、l01 kPa时,0.1NA个H2分子完全燃烧生成液态水,放出akJ热量,表示氢气燃烧热的热化学方程式为H2(g)+
| |||||||||||
| D、常温下28g14CO中含有14NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com