
分析 相等氧原子数,令O原子为1mol,则SO2为$\frac{1}{2}$mol,SO3为$\frac{1}{3}$mol;
(1)根据N=nNA计算;
(2)根据分子的物质的量结合分子组成计算;
(3)根据m=nM计算.
解答 解:相等氧原子数,令O原子为1mol,则SO2为$\frac{1}{2}$mol,SO3为$\frac{1}{3}$mol;
(1)由N=nNA可知,分子数目之比为$\frac{1}{2}$:$\frac{1}{3}$=3:2;
故答案为:3:2;
(2)SO2为$\frac{1}{2}$mol,SO3为$\frac{1}{3}$mol,则含有原子总数之比为($\frac{1}{2}$mol×3):($\frac{1}{3}$mol×4)=9:8;
故答案为:9:8;
(3)由m=nM可知,则分子质量之比为$\frac{1}{2}$×64:$\frac{1}{3}$×80=6:5,故答案为:6:5.
点评 本题考查物质的量的计算,侧重于学生的计算能力的考查,有利于学习的积极性的培养,难度不大,注意相关计算公式的运用以及物质的分子构成.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
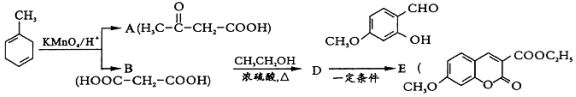
 的官能团名称为碳碳双键.
的官能团名称为碳碳双键.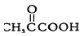 的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.
的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.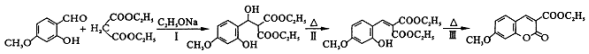
 中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.
中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.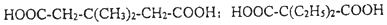 .
.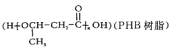
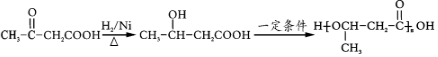 .(无机试剂任用)
.(无机试剂任用)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④⑤ | C. | ④⑥ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )| A. | b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 图中b、c、d、三点溶液中水的电离程度最大的是c点 | |
| C. | b点后滴加NaOH溶液过程中,NH3•H2O的电离程度逐渐减小 | |
| D. | pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com