
【题目】下列关系正确的是
A. 沸点:己烷>2-甲基丁烷>戊烷>丁烷
B. 2,2,3,3-四甲基丁烷、新戊烷、乙烷中化学环境相同的H原子种类由多到少
C. 密度:溴苯 >H2O >苯
D. 等物质的量物质燃烧耗O2量:己烷>苯>C6H5COOH
【答案】C
【解析】A.常温下,烷烃的碳原子数越多,沸点越高,碳原子数相同时,支链越多,沸点越低,沸点:己烷>戊烷>2-甲基丁烷>丁烷,故A错误;B.2,2,3,3-四甲基丁烷的结构简式为:(CH3)3CC(CH3)3分子中有1种氢原子,新戊烷的结构简式为:(CH3)4C分子中有1种氢原子,乙烷的结构简式为:CH3CH3分子中有1种氢原子,故三者化学环境相同的氢原子种类相同,故B错误;C.溴苯的密度大于水,烃的密度比水小,故C正确;D.等物质的量的烃CxHy或烃的衍生物CxHyOz完全燃烧,耗氧量取决(x+![]() )或(x+
)或(x+![]() -
-![]() ),该值越大,耗氧量越多,己烷、苯、C6H5COOH的(x+
),该值越大,耗氧量越多,己烷、苯、C6H5COOH的(x+![]() )或(x+
)或(x+![]() -
-![]() ),值分别为:9.5、7.5、7.5,故己烷耗氧量最多,苯和苯甲酸耗氧量相同,故D错误;故选C。
),值分别为:9.5、7.5、7.5,故己烷耗氧量最多,苯和苯甲酸耗氧量相同,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】有关乙烯、苯分子的的描述不正确的是 ( )
A. 碳原子都采用sp2杂化 B. 分子中都含有σ键和π键
C. 分子都是平面结构 D. 都能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:______________。
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4,该元素的名称是____________。
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有____ mol配位键。
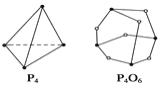
(5)化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O===O:498,则反应P4(白磷)+3O2===P4O6的反应热ΔH为______。
(6)写出二氧化硫中的S原子和水合氢离子中O原子分别采用______和______杂化形式,二氧化硫分子和水合氢离子其空间构型分别为________和__________。
(7)HF水溶液中含有的氢键共_______________种。
(8)无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。
CoCl2+xH2O = CoCl2·xH2O
深蓝色 粉红色
现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。(CoCl2的相对分子质量:131)
①水合物中x=________。
②若该化合物中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-的个数比为1∶1,则其化学式可表示为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜、阴离子交换膜、石墨电极和如图Z99所示电解槽。用氯碱工业中的离子交换技术原理,可电解Na2SO4溶液生产NaOH和H2SO4溶液。

下列说法正确的是( )
A.阳极反应式为2H++2e-===H2↑
B.从A口出来的是H2SO4溶液
C.a是阳离子交换膜,允许H+通过
D.Na2SO4溶液从E口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。_____________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___________。其中氮元素原子最外层电子排布的轨道表达式是_____________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是_______。醋酸二氨合铜中铜的配位数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.棉花和蚕丝的主要成分都是纤维素
B.蛋白质在一定条件发生水解反应生成葡萄糖
C.酶是一类具有催化作用的蛋白质,其催化作用有很强的专一性、高效性
D.食用植物油的主要成分是不饱和高级脂肪酸甘油酯,属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生社团根据老师的指导进行实验研究:一块下衬白纸的玻璃片上有a、b、c、d四个位置,分别滴加浓度为0.1 mol/L的四种溶液各1滴,每种彼此分开,形成一个个小液滴。在圆心e处放置2粒芝麻粒大小的KMnO4晶体,然后向KMnO4晶体滴加一滴浓盐酸,并将表面皿盖好。可观察到a、b、c、d、e五个位置均有明显反应。
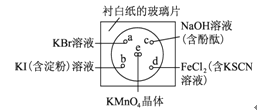
完成下列填空:
(1).e处立即发生反应,化学方程式如下,请配平,并标出电子转移方向和数目。___________
![]() KMnO4+
KMnO4+![]() HCl(浓)→
HCl(浓)→![]() KCl+
KCl+![]() MnCl2+
MnCl2+![]() Cl2↑+
Cl2↑+![]() H2O
H2O
(2).在元素周期表中Cl、Br、I位于___________________ 族 ,它们最高价氧化物所对应水化物酸性最强的是__________________(填化学式)。
(3).b处实验现象为________________________。d处反应的离子方程式为____________________________________________,通过此实验________(填“能”或“不能”)比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱。若能,则其氧化性由强到弱的顺序是___________________________________。
(4).常温下,向饱和氯水中逐滴滴入0.1mol/L的氢氧化钠溶液,pH变化如下图所示,下列有关叙述正确的是________
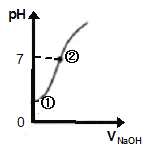
A.①处所示溶液中存在的电离平衡不止一个
B.由①到②的过程中,溶液由酸性逐渐变为碱性
C.由①到②的过程中,水的电离程度逐渐减弱
D.②处所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知33As、35Br位于同一周期.下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3﹣>S2﹣>Cl﹣
D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com