
| A. | 构成原电池的正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液构成的原电池中铜是负极 | |
| C. | 铜铁原电池工作时,若有2.8 g铁被溶解,电路中就有0.15mol电子通过 | |
| D. | 由镁、铝作电极与NaOH溶液构成的原电池中铝是负极 |
分析 A.原电池的两极可为金属,也可为金属和非金属;
B.负极为较活泼金属;
C.在“铜铁原电池”中,活泼金属铁是负极,失电子,根据负极反应计算;
D.原电池工作时,失电子的一极为负极.
解答 解:A.原电池的两极可为金属,也可为金属和非金属,常用石墨作正极,如为燃料电池,两个电极都可为非金属,故A错误;
B.负极为较活泼金属,应为锌,故B错误;
C.在“铜铁原电池”中,活泼金属铁是负极,失电子,反应为Fe-2e-═Fe2+,所以有2.8 g铁被溶解,电路中就有$\frac{2.8g}{56g/mol}$×2=0.1mol电子通过,故C错误;
D.失电子的一极为负极,在镁、铝、稀NaOH溶液组成的原电池中,Al失电子为负极,故D正确.
故选D.
点评 本题考查原电池知识,较为综合,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,难度不大,注意相关基础知识的积累.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢铵溶液中加足量石灰水:NH4++HCO3-+Ca2++2OH-=CaCO3↓+NH3•H2O+H2O | |
| B. | 碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O | |
| C. | 滴有石蕊的烧碱溶液里通CO2至颜色变红:CO2+2OH-=CO32-+H2O | |
| D. | 漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中的C、H、O的个数比为1:2:3 | B. | 分子中C、H个数比为1:2 | ||
| C. | 该有机物的相对分子质量为14 | D. | 该分子中肯定不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
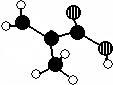 化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
化工厂生产的某产品只含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
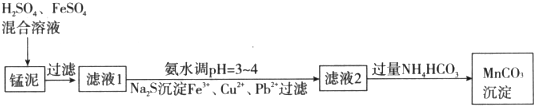
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com