
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
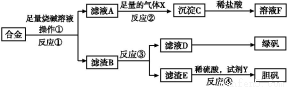
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
实验编号 | ① | ② | ③ | ④ |
稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
NO体积(L) | 1.12 | 2.24 | 3.36 | V |
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。
(1)烧杯、漏斗、玻璃棒
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)取少量滤液D加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色最后变成红褐色(合理即可)
(4)Cu+H2O2+H2SO4+3H2O=CuSO4·5H2O(或Cu+H2O2+H2SO4=CuSO4+2H2O)
(5)铁粉与杂质铜形成原电池,加快了反应速率 因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O 晶体
(6)2 mol/L 4.8 g 4.48
【解析】(1)操作①是过滤。(2)金属中只有铝能和氢氧化钠溶液反应生成AlO2-, AlO2-和足量CO2生成Al(OH)3沉淀和HCO3-。(3)滤液D中含有Fe2+,可以利用其和碱生成沉淀时的颜色变化、自身不能使KSCN溶液变红而氧化后变红的性质进行检验。(4)H2O2是绿色氧化剂,还原产物是H2O。(5)里面有杂质铜,形成原电池,加快了反应速率;Fe3+很易发生水解。(6)滤渣B中含有Fe和Cu,分析实验①到②和②到③的过程可知:①到②时,金属过量,硝酸完全反应,100 mL HNO3共产生 =0.05 mol NO,消耗金属4.2 g,由反应:
=0.05 mol NO,消耗金属4.2 g,由反应:
3Fe + 8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
3×56 g 8 mol 2 mol
4.2 g 0.2 mol 0.05 mol
知:消耗的4.2 g金属恰好为Fe,且可推知①中消耗的也为Fe且质量为4.2 g,同时求得HNO3的浓度为: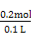 =2 mol·L-1。又由反应:
=2 mol·L-1。又由反应:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3×64 g 2 mol
m(Cu) 0.05 mol
得:m(Cu)=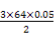 g=4.8 g可知:②到③中溶解的4.8 g金属恰好是Cu,即铜的总质量即为4.8 g;根据前面的分析可知:④与③相比多加的100 mL HNO3是与Fe2+反应:
g=4.8 g可知:②到③中溶解的4.8 g金属恰好是Cu,即铜的总质量即为4.8 g;根据前面的分析可知:④与③相比多加的100 mL HNO3是与Fe2+反应:
3Fe2+ + 4H+ + NO3-=3Fe3++NO↑+2H2O
3 mol 4 mol 1 mol 22.4 L
0.15 mol 0.2 mol0.2 mol V′
即V′=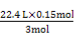 =1.12 L。
=1.12 L。
故V=3.36+1.12=4.48。


科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:选择题
已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2=3Fe3++2Cl-
B.向溴水中加入足量氯化亚铁溶液能使溴水变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O=2HClO+CO32-
D.能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:填空题
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:

(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:________________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为______________________。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
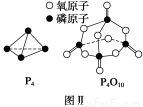
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:选择题
“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液;②是胶体;③能产生丁达尔效应;④能透过滤纸;⑤不能透过滤纸;⑥静置后会析出黑色沉淀
A.①④⑤ B.②③④
C.②③⑤ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:选择题
下列物质属于电解质的是( )
A.NaCl溶液 B.SO3 C.Na2O D.Cu
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题9金属及其化合物练习卷(解析版) 题型:选择题
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是( )
A.只有①或② B.只有①或②或④
C.只有①或②或③ D.上述任意一种
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:选择题
(1)某小组为研究电化学原理,设计如图装置,下列叙述正确的是 。

A.若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-=Cu
B.若a和b为石墨,通电后滴入酚酞,a电极附近溶液呈红色
C.若a为铜,b为铁,通电后Cu2+向a电极移动
D.若a为粗铜,b为纯铜,通电后b电极质量增加
(2)电镀时,镀件与电源的 极连接。化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法: 。

查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:选择题
下表是三种难溶金属硫化物的溶度积常数(25 ℃)。
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
下列有关说法中正确的是( )
A.25 ℃时,CuS的溶解度大于MnS的溶解度
B.25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol/L
C.因为H2SO4是强酸,所以反应CuSO4+H2S CuS↓+H2SO4不能发生
CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题3氧化还原反应 离子反应练习卷(解析版) 题型:选择题
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2 +O2+aOH-
+O2+aOH- Y+S4
Y+S4 +2H2O,下列说法中,不正确的是( )
+2H2O,下列说法中,不正确的是( )
A.a=4
B.Y的化学式为Fe2O3
C.S2 是还原剂
是还原剂
D.每有1 mol O2参加反应,转移的电子为4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com