
| A. | 活性炭 | B. | 氯气 | C. | 明矾 | D. | 次氯酸钠 |
分析 A.活性炭具有吸附性;
B.氯气和水反应生成的次氯酸具有强氧化性;
C.明矾是溶于水溶液中铝离子水解生成了氢氧化铝胶体,能吸附悬浮杂质;
D.次氯酸钠溶液中次氯酸根离子水解生成了具有氧化性的次氯酸.
解答 解:A.活性炭具有较大表面积,具有吸附性,能吸附水中杂质,与胶体无关,故A不符合;
B.氯气和水反应生成的次氯酸具有强氧化性,次氯酸能杀菌消毒净化水,和胶体无关,故B不符合;
C.明矾是溶于水溶液中铝离子水解生成了氢氧化铝胶体,具有较大表面积能吸附水中悬浮杂质净水,和胶体有关,故C符合;
D.次氯酸钠溶液中次氯酸根离子水解生成了具有氧化性的次氯酸,次氯酸能杀菌消毒净化水,和胶体无关,故D不符合;
故选C.
点评 本题考查了物质性质和应用,主要是净水原理的分析判断,注意知识的积累,掌握基础是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Mg2+、Ag+、CO32-、Cl- | ||
| C. | K+、NH4+、SO42-、Cl- | D. | K+、Na+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制450mL溶液需要用到450mL容量瓶 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 称量NaOH 固体时,将NaOH 固体放在托盘天平左盘的纸上 | |
| D. | 蒸馏时,应将温度计水银球靠近蒸馏烧瓶的支管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
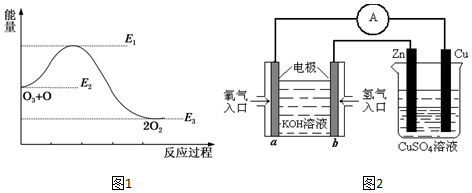
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
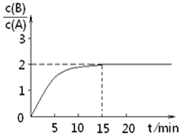 某温度下在2L密闭容器中加人一定量A,发生以下化学反应:
某温度下在2L密闭容器中加人一定量A,发生以下化学反应:| A. | 反应达平衡时,A的转化率为80% | |
| B. | A的初始物质的量为4mol | |
| C. | 反应到达平衡时,放出的热量是193kJ | |
| D. | 15min时,v正=v逆=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
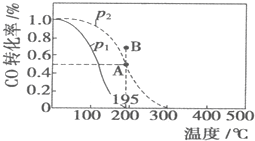 在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示
在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | P1>P2,a<0 | |
| B. | 在P2及195℃时,反应前3min的平均速率v(CH3OH)=0.08mol/(L•min) | |
| C. | 在P2及195℃时,该反应的平衡常数为25(mol/L)-2 | |
| D. | 在B点时,v正>v逆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com