
 常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25 mL 0.1ml•L-1NaOH溶液中逐滴加入 0.1 mo1•L-1CH3C00H溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A. | 曲线上任一点:c(Na+)+c(H+)=c(0H-)+c(CH3C00H) | |
| B. | 在 B点,a=25,且有 c(Na+)=c(CH3C00-)>c(0H-)=c(H+) | |
| C. | 在C点:c(Na+)>c(CH3C00-)>c(H+)>c(0H-) | |
| D. | 在D点:c(CH3C00-)+c(CH3C00H)=2c(Na+) |
分析 A.根据溶液的电荷守恒判断;
B.B点时溶液pH=7,结合醋酸为弱电解质进行判断;
C.C点溶液呈酸性,醋酸过量;
D.D点n(CH3COOH)=2n(NaOH),从物料守恒的角度分析.
解答 解:A.根据电荷守恒可知,曲线上任一点均有Na+、H+、CH3COO-、OH-等离子存在,根据溶液的电荷守恒可知都存在c(Na+)+c(H+)=c(CH3COO-)+(OH-),故A错误;
B.B点时溶液pH=7,醋酸溶液适当过量,则a>25,根据溶液的电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+(OH-),则c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C.C点溶液呈酸性,醋酸过量,溶液呈酸性,存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.D点n(CH3COOH)=2n(NaOH),根据物料守恒可知c(CH3COO-)+c(CH3COOH)=2c(Na+),故D正确.
故选D.
点评 本题综合考查离子浓度大小比较,题目难度不大,注意结合物料守恒以及电荷守恒解答该题,易错点为A,注意A到D之间溶液中都存在Na+、H+、CH3COO-、OH-等离子,从电荷守恒的角度解答该题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应、稀醋酸与稀NaOH溶液反应所测得的中和热都为△H=-57.3kJ/mol | |
| B. | 由C(石墨,s)═C(金刚石,s)△H=+1.9kJ/mol,可知金刚石比石墨稳定 | |
| C. | 在用标准盐酸滴定未知浓度氢氧化钠溶液的实验中,若用待测液润洗锥形瓶,则测定结果偏低(其他操作正确) | |
| D. | 向存在着FeCl3 (黄色)+3KSCN?Fe(SCN)3(血红色)+3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于周期表中同一周期的元素,原子具有相同的电子层数 | |
| B. | 凡是位于周期表中同一主族的元素,原子具有相同的最外层电子数 | |
| C. | 凡是位于周期表中同一周期的元素,都是按从左到右的顺序原子核外最外层电子数由1递增至8 | |
| D. | 凡是位于周期表中同一主族的元素,都是按从上到下的顺序原子核外电子层数逐渐递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 预测现象 |
| A | 将SO2通入紫色石蕊溶液中 | 石蕊溶液先变红后褪色 |
| B | 将CO2气体通入足量的CaCl2溶液中 | 产生白色沉淀 |
| C | 常温下,将用砂纸打磨过的铝片投入浓硫酸中 | 产生刺激性气体 |
| D | 将酸性高锰酸钾溶液滴入足量的乙醇中 | 高锰酸钾溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
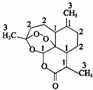 我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )
我国药学家屠呦呦教授因发现并提纯青蒿素而获得2015 年诺贝尔奖.青蒿素是用于治疗疟疾的药物,其结构简式如图:下列有关青蒿素的叙述正确的是( )| A. | 分子式为 C15H2205 | B. | 有较强的还原性,能杀死疟原虫 | ||
| C. | 易溶于水、酒精等溶剂 | D. | 能发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
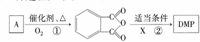
 )是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示:
)是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示:
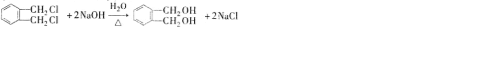 .
.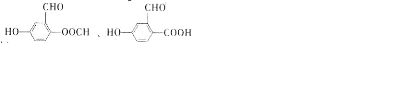 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,把试管放入盛有25度时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL盐酸,试回答下列问题.
如图所示,把试管放入盛有25度时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL盐酸,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题:
硫及其化合物在药物、造纸、炸药及石油加工等方面具有广泛应用.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com