
 过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。
过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证乙装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过 %(质量分数)。| 化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
| 溶解度(g/100gH2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
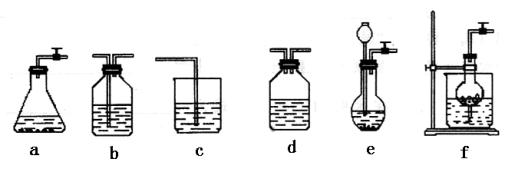
| 选择的装置(填序号) | f | b |
| 选择的药品(填序号) | ②⑥ | ④ |


科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 制500mL 0.1mol·L—1 CuSO4溶液。根据题意填空:
制500mL 0.1mol·L—1 CuSO4溶液。根据题意填空:  (填仪器名称)。
(填仪器名称)。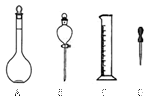
 应用托盘天
应用托盘天 平称
平称 取 g无水CuSO4。
取 g无水CuSO4。 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
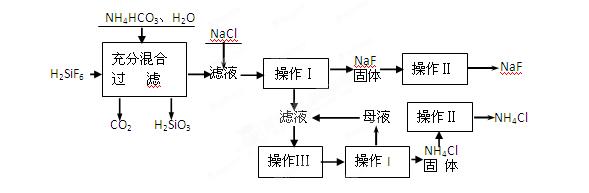
| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF—4 0℃NH4F—100; 常温Na2SiF6微溶于水 |
| NH4Cl溶解度 | 33 .3 .3 | 37.2 | 41.4 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
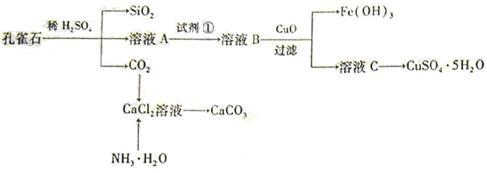
 ),检验溶液A中Fe3+的最佳试剂为 (填代号)。
),检验溶液A中Fe3+的最佳试剂为 (填代号)。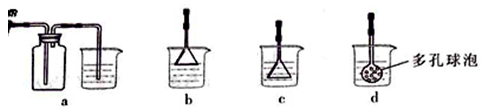
 )欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度 。(填“偏高”、“偏低”、“无影响”。)
)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度 。(填“偏高”、“偏低”、“无影响”。)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
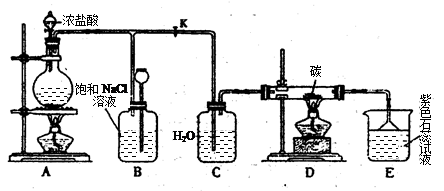
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
 形瓶内溶液颜色的变化,当锥形瓶内溶液由
形瓶内溶液颜色的变化,当锥形瓶内溶液由| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 1.00mL | 25.02mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com